题目内容
【题目】溶液与人们的生活息息相关。
(1)不同物质在水中的溶解能力不同,下列物质属于难溶性盐的是____(写化学式,下同);属于可溶性碱的是______,属于可溶性盐的_____。
①氢氧化钾
②硫酸钡
③氢氧化铁
④氯化银
⑤硝酸镁
(2)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度降低。这种物质是____(填字母)
A 氢氧化钠
B 硝酸铵
C 氯化钠
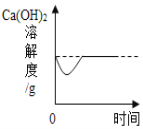
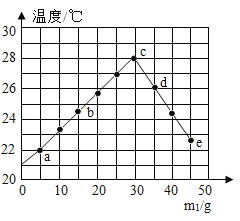
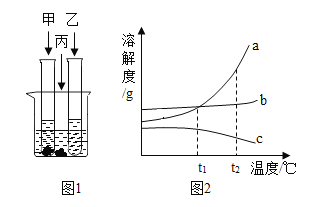
(3)室温下,将甲、乙、丙三种固体分别充分溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙固体有剩余,乙固体全部溶解。升温到 80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化。
①室温下,______(选填“甲”、“乙”、“丙”)溶液一定是饱和溶液。
②图2中能表示乙物质的溶解度曲线的是_____(填“a”、“b”或“c”)。
③t1℃时,甲、丙两物质饱和溶液中溶质质量分数:甲____丙(填“>”、“<”或“=”)。
【答案】BaSO4、AgCl KOH Mg(NO3)2 B 甲丙 c =
【解析】
(1)①氢氧化钾:是电离时产生的阴离子全部都是氢氧根离子的化合物,属于碱,且氢氧化钾易溶于水;
②硫酸钡:是由钡离子和硫酸根离子构成的化合物,属于盐,且难溶于水;
③氢氧化铁:是电离时产生的阴离子全部都是氢氧根离子的化合物,属于碱。难溶于水;
④氯化银:是由氯离子和银离子构成的化合物,属于盐,难溶于水;
⑤硝酸镁:是由镁离子和硝酸根离子构成的化合物,属于盐,难溶于水。
下列物质属于难溶性盐的是BaSO4、AgCl;属于可溶性碱的是KOH;属于可溶性盐的是:Mg(NO3)2;
(2)A、氢氧化钠溶于水放出大量的热,使温度升高,不符合题意;
B、硝酸铵溶于水吸热,使温度降低,符合题意;
C、氯化钠溶于水,温度变化不大,不符合题意。
故选B;
(3)①室温下,将甲、乙、丙三种固体分别充分溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙固体有剩余,乙固体全部溶解,甲、丙有固体剩余,一定是饱和溶液;乙固体全部溶解,可能是恰好达到饱和,也可能是不饱和溶液,故填:甲、丙;
②室温下,甲、丙固体有剩余,乙固体全部溶解,升温后,甲固体全部溶解,乙固体有晶体析出,丙固体没有明显变化,说明乙的溶解度随温度的升高而减小,甲的溶解度随温度的升高而增加,丙的溶解度受温度的影响较小,故图2中能表示乙物质的溶解度曲线的是:c,能表示甲物质溶解度曲线的是a,能表示丙物质溶解度曲线的是b,故填:c;
③由图可知,t1℃时,a、b的溶解度曲线相交,说明该温度下,甲、丙的溶解度相等,故该温度下,甲、丙两物质饱和溶液中溶质质量分数:甲=丙。

【题目】小美网购了一种管道疏通剂, 其主要成分是氢氧化钠和碳酸钠中的一种或两种。小美和兴趣小组同学对这种管道疏通剂的成分进行了探究:
[提出问题]该管道疏通剂的成分是什么?
[猜想]猜想一:碳酸钠;
猜想二:氢氧化钠;
猜想三:氢氧化钠和碳酸钠。
[设计与实验] (假设管道疏通剂中其他成分不影响其主要成分的检测)
本次实验所需试剂只能从下列试剂中选择:蒸馏水,澄清石灰水、氯化钡溶液、稀盐酸、 氯化铜溶液、酚酞溶液。
方案 | 操作 | 现象 | 结论 |
一 | 取一包装良好的管道疏通剂,拆开包装,取样于试管中,加水溶解,滴入澄清石灰水 | 出现白色沉淀 | 猜想一正确,反应的化学方程式为__________ |
二 | 取一包装良好的管道疏通剂,拆开包装,取样于试管中,加入适量的水溶解,再滴加足量的________溶液后,取上层清液滴入酚酞试液 | ____________ | 猜想三正确 |
[讨论]小组同学认为方案一的结论不严谨, 理由是_________________。
[拓展](1)结合上述探究分析,这种管道疏通剂不能与皮肤接触,其原因是_____________。
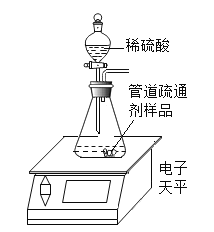
(2)为定量测定这种管道疏通剂中碳酸钠的含量,小美设计如图所示实验,小江认为实验时不用检查装置气密性,你同意小江的观点吗?并说明理由______________________。
【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11g样品及足量的水配成溶液;②向三个烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到wg的白色固体.实验数据如下:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入CaCl2的质量/g | 5.55 | 12 | 15 |
W/g | 5 | 10 | 10 |
回答下列问题:
(1)将烧杯Ⅲ中的溶液蒸干,得到 g固体,该固体由 和 组成(只填化学式).
(2)样品中碳酸钠的质量分数是多少?