题目内容
【题目】寒假期间,某兴趣小组同学对“锌与硫酸反应快慢的影响因素”进行探究。
[提出问题] 锌与硫酸反应的快慢与哪些因素有关?
[猜想假设](1)a、可能与锌的形状、颗粒大小有关;
b、可能与硫酸的质量分数大小有关;
c、还可能与______有关。
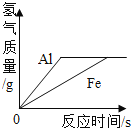
[设计与实验] 以3分钟内收集到的氢气体积作为判断依据,具体如下表所示:
实验 编号 | 锌的形状 (均取1 g) | 硫酸的浓度 (均取20 mL) | 氢气的体积 (/mL) |
① | 锌粒 | 20% | 31.7 |
② | 锌片 | 20% | 50.9 |
③ | 锌粒 | 30% | 61.7 |
④ | 锌片 | 30% |
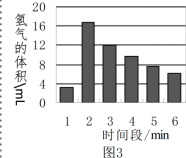
[比较分析](2)要验证猜想a ,可选择的实验编号是_______________。
(3)实验④由于没有及时记下数据,经同学回忆,你认为比较可能的数值是__________(填“57.5”或“75.5”)。
[得出结论](4)完成实验①②③后,可以得出影响该反应快慢的一条结论是:________。
[反思评价] 图3是用实验①来测定,在每一分钟内收到氢气的体积变化图,请
(5)第1分钟时间内反应的速率较慢,这是由于锌粒表面有些氧化膜(ZnO)覆盖,则其原因用化学方程式表示为______。
(6)从第3分钟开始,反应的速率又逐渐变______,这是因为______。
【答案】温度 ①② 75.5 相同条件下,硫酸浓度越大,反应速度越快 ![]() 慢 锌与硫酸反应,硫酸不断被消耗,硫酸溶质质量分数变小,反应变慢
慢 锌与硫酸反应,硫酸不断被消耗,硫酸溶质质量分数变小,反应变慢
【解析】
[猜想假设]
(1)c、在酸与较活泼金属反应过程中,刚反应时,反应放出热量,反应较快,所以锌与硫酸反应的快慢还可能与温度有关。
[比较分析]
(2)验证猜想a:可能与锌的形状、颗粒大小有关,应选择的实验①②,酸的浓度相同,锌的形状、颗粒大小不同,观察相同时间产生氢气的快慢。
(3)实验④由于没有及时记下数据,可能的数值是75.5。因为从实验①②对比可知,相同硫酸的条件下,锌片比锌粒反应速率要快,则产生氢气要比61.7大。
[得出结论]
(4)完成实验①②③后,通过对比①③实验,锌粒相同,硫酸浓度不同,相同时间产生氢气的量不同。可以得出影响该反应快慢因素是:相同条件下,硫酸浓度越大,反应速度越快。
[反思评价]
(5)第1分钟时间内反应的速率较慢,这是由于锌粒表面有些氧化膜(ZnO)覆盖,硫酸先与氧化锌反应生成硫酸锌和水,化学方程式表示为![]() 。
。
(6)从第3分钟开始,反应的速率又逐渐变慢,这是因为锌与硫酸反应,硫酸不断被消耗,硫酸溶质质量分数变小,反应变慢。

【题目】分类、类比是学习化学常用的有效方法。
(1)初中化学有许多实验,若按照实验的主要目的可将实验分为:探究化学反应前后物质的质量关系、探究物质的性质、探究物质的含量等。请根据探究物质的某种性质将下列实验中的E与_________(填字母)归为一类;依据是______________。
氢气的验纯 |
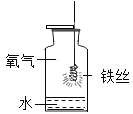
铁丝燃烧 |
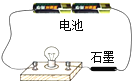
石墨导电实验 |
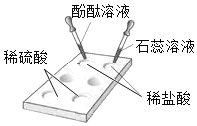
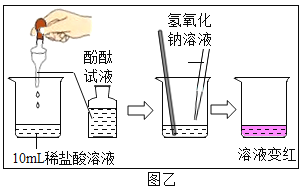
酸与指示剂作用 |
比较硬度实验 |
A | B | C | D | E |
(2)碳元素和硅元素在元素周期表中同属第Ⅳ主族,它们具有相似的化学性质,它们氧化物也具有相似的化学性质。例如:二氧化碳和碱溶液能发生反应,而二氧化硅也能和氢氧化钠溶液反应,则反应后生成的盐的名称是___________,反应的化学方程式为:_____________。