题目内容
【题目】实验课上同学们对酸碱盐的性质作了如下探究。
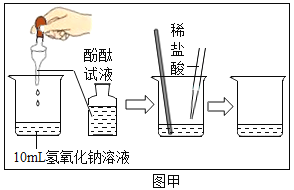
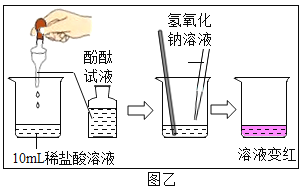
(1)小海探究了中和滴定实验,操作如下图甲所示,当他观察到____________时,说明恰好完全反应。写出反应的化学方程式__________________。
(2)小郝对一瓶敞口放置的氢氧化钠溶液产生兴趣,他想探究该溶液是否完全变质。取样后先加入__________溶液,有白色沉淀生成。过滤。滤液中加入无色酚酞溶液,观察到溶液变红,他推断该氢氧化钠溶液部分变质。
(3)小亮则根据所学知识绘制了如下图所示物质间关系网络图,并做了相关实验。(“—”表示相连的两种物质能发生反应,“→”表示某物质可以转化为另一种物质。)已知A为胃酸的主要成分,B是贝壳的主要成分,D微溶于水,A与F反应生成气体。
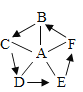
① 写出物质D的俗称__________;
② 写出C→D 的现象_________;
③ 写出E→F的化学方程式_________;
④ 写出物质E的一点用途_________________;
【答案】溶液恰好变为无色 NaOH+HCl=NaCl+H2O 过量的CaCl2 熟石灰 放热 2NaOH+CO2=Na2CO3+H2O 制肥皂、石油工业、造纸、纺织工业、印染 等(写一即可)
【解析】
(1)氢氧化钠显碱性,能使无色酚酞试液变红,向氢氧化钠溶液中滴加稀盐酸,氢氧化钠与稀盐酸反应生成氯化钠和水,氯化钠显中性,不能使无色酚酞变色,故溶液恰好变为无色时,说明恰好完全反应,氢氧化钠与稀盐酸反应生成氯化钠和水,该反应的化学方程式为:![]() ,故填:溶液恰好变为无色;
,故填:溶液恰好变为无色;![]() ;
;
(2)氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水,通过实验推断出该氢氧化钠部分变质,故应加入某种试剂,验证碳酸钠的存在并除去碳酸根,防止对氢氧化钠的验证产生影响,可加入过量氯化钙,氯化钙能与碳酸钠反应生成碳酸钙和氯化钠,有白色沉淀产生,说明含碳酸钠,并除去了碳酸钠,过滤,滤液中加入无色酚酞试液,氢氧化钠显碱性,能使无色酚酞试液变红,故溶液变红,说明含氢氧化钠,可推出氢氧化钠溶液部分变质;
(3)已知A为胃酸的主要成分,可推出A为盐酸,B是贝壳的主要成分,可推出B为碳酸钙,碳酸钙能转化为C,C能转化为D,D微溶于水,且盐酸能与C、D反应,可推出C为氧化钙,D为氢氧化钙,D能转化为E,E能转化为F,F能与盐酸反应生成气体,E也能与盐酸反应,可推出E为氢氧化钠,F为碳酸钠。
①D为氢氧化钙,氢氧化钙的俗称是熟石灰;
②C为氧化钙,D为氢氧化钙,氧化钙与水反应生成氢氧化钙,放出大量的热,故现象为:放热;
③E为氢氧化钠,F为碳酸钠,氢氧化钠能与二氧化碳反应生成碳酸钠和水,该反应的化学方程式为:![]() ;
;
④ E为氢氧化钠,氢氧化钠能与高级脂肪酸反应用于制肥皂、氢氧化钠具有腐蚀性,且不与纤维素反应,故可用于造纸、纺织工业等。

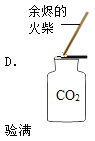
【题目】实验室有一瓶标签受损的无色溶液(标签如图所示)。同学们决定对其成分进行探究。他们首先向老师请教,老师告诉他们初中化学实验室中的含钠化合物可能是NaOH、NaCl、Na2SO4、NaNO3、Na2CO3、NaHCO,并给出相关资料,让同学们结合所学知识进行探究。
![]()
(相关资料)(1)NaOH、Na2CO3、NaHCO3的溶液呈碱性,NaCl、Na2SO4、NaNO3的溶液呈中性。
(2)NaHCO3属于可溶物质(室温下溶解度小于10g),而其它物质属于易溶物质(室温下溶解度大于10g)。
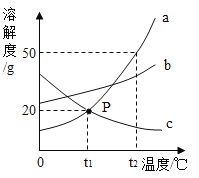
(交流讨论)同学们一致认为该溶液一定不是NaHCO3溶液,他们的理由是____。
(实验探究)为确定该溶液的成分,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与____进行比较 | 试纸条变蓝 | 该溶液的pH=10,通过比较。可能是____。 |
Ⅱ | 取少量溶液于试管中向其中滴加足量的稀盐酸。 | ____ | 该溶液为Na2CO3溶液。有关反应的化学方程式为____。 |
(反思评价)老师指出该结论不严密。理由是若该溶液为NaOH溶液,在空气中发生变质,也能产生上述现象。请写出NaOH在空气中变质反应的化学方程式:____。
【题目】寒假期间,某兴趣小组同学对“锌与硫酸反应快慢的影响因素”进行探究。
[提出问题] 锌与硫酸反应的快慢与哪些因素有关?
[猜想假设](1)a、可能与锌的形状、颗粒大小有关;
b、可能与硫酸的质量分数大小有关;
c、还可能与______有关。
[设计与实验] 以3分钟内收集到的氢气体积作为判断依据,具体如下表所示:
实验 编号 | 锌的形状 (均取1 g) | 硫酸的浓度 (均取20 mL) | 氢气的体积 (/mL) |
① | 锌粒 | 20% | 31.7 |
② | 锌片 | 20% | 50.9 |
③ | 锌粒 | 30% | 61.7 |
④ | 锌片 | 30% |
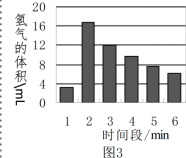
[比较分析](2)要验证猜想a ,可选择的实验编号是_______________。
(3)实验④由于没有及时记下数据,经同学回忆,你认为比较可能的数值是__________(填“57.5”或“75.5”)。
[得出结论](4)完成实验①②③后,可以得出影响该反应快慢的一条结论是:________。
[反思评价] 图3是用实验①来测定,在每一分钟内收到氢气的体积变化图,请
(5)第1分钟时间内反应的速率较慢,这是由于锌粒表面有些氧化膜(ZnO)覆盖,则其原因用化学方程式表示为______。
(6)从第3分钟开始,反应的速率又逐渐变______,这是因为______。
【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
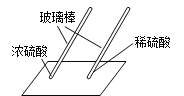
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
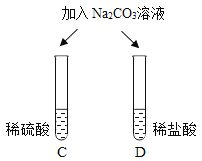
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
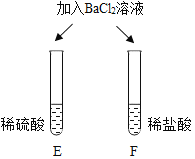
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。