题目内容
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其它杂质忽略不计)。为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g,(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试计算: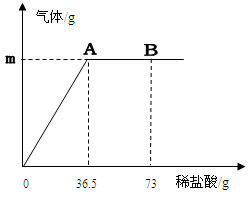
(1)A点产生气体的质量m=_________。
(2)试样中碳酸钠的质量分数(结果精确至0.1%)。
(3)B点时,烧杯内溶液中的溶质是__________(写出化学式)。
(1) 2.2g (2)83.3% (3)NaCl、HCl
解析试题分析:依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量为生成的二氧化碳的质量;利用化学方程式二氧化碳与碳酸钠的质量比即可计算出碳酸钠的质量;根据图示,A点表示恰好完全反应,B点表示盐酸过量,可知B点时溶质有氯化钠和过量的盐酸。
解:(1)生成的二氧化碳的质量=6g+36.5g-40.3g=2.2g
(2)设碳酸钠的质量为x;
Na2CO3+2HCl==2NaCl+H2O+CO2↑
44
X 2.2g
106/44 =x/2.2g
X=5.3g
试样中碳酸钠的质量分数=5.3g/6g ×100% =83.3%
(3)B点表示盐酸过量,可知B点时溶质有氯化钠和过量的盐酸
答:略
考点:利用化学方程式的计算

练习册系列答案
相关题目
某同学为了测定NaCl和MgCl2固体混合物中MgCl2的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的NaOH溶液,获得如下实验数据:
| 实验次数 | 一 | 二 | 三 | 四 |
| 固体混合物的质量(g) | 20 | 20 | 20 | 20 |
| 加入NaOH溶液的质量(g) | 20 | 40 | 60 | 80 |
| 生成沉淀的质量(g) | 2.9 | m | 8.7 | 8.7 |
(2)原固体混合物中MgCl2的质量分数是多少?(8分)(要求写出计算过程)