题目内容
【题目】如图所示,在乙瓶中放入用石蕊溶液染成紫色的干燥的纸花,在 A 处缓缓地持续通入混合气体 X,下表中的物质及实验操作后的现象对应关系不正确的是
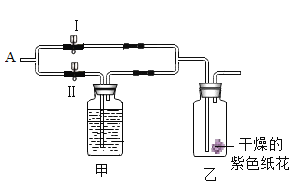
选项 | 气体 X | 甲中盛放的溶液(足量) | 关闭Ⅰ阀打开Ⅱ阀 |
A | 潮湿的混有一氧化碳的二氧化碳 | 浓硫酸 | 纸花不变色 |
B | 干燥的混有一氧化碳的二氧化碳 | 氢氧化钠溶液 | 纸花变为红色 |
C | 潮湿且混有氯化氢的二氧化碳 | 氢氧化钠溶液 | 纸花不变色 |
D | 干燥且混有氯化氢的二氧化碳 | 饱和碳酸氢钠溶液 | 纸花变为红色 |
A.AB.BC.CD.D
【答案】B
【解析】
A、浓硫酸具有吸水性,能吸收混合气体中的水分,干燥的二氧化碳不能使紫色石蕊纸花变色,不符合题意;
B、将混合气体通入氢氧化钠溶液中。氢氧化钠与二氧化碳反应生成碳酸钠和水,一氧化碳不能使紫色石蕊纸花变色,符合题意;
C、将潮湿且混有氯化氢的二氧化碳通入氢氧化钠中,氯化氢能与氢氧化钠反应生成氯化钠和水,二氧化碳能与氢氧化钠反应生成碳酸钠和水,氢氧化钠吸收了氯化氢和二氧化碳,紫色石蕊纸花不变色,不符合题意;
D、将干燥且混有氯化氢的二氧化碳,通入饱和碳酸氢钠溶液中,氯化氢能与碳酸氢钠反应生成氯化钠、二氧化碳和水,饱和碳酸氢钠不吸收二氧化碳,二氧化碳从饱和碳酸氢钠溶液中携带出水蒸气,二氧化碳与水反应生成碳酸。碳酸显酸性,能使紫色石蕊纸花变红,不符合题意。
故选B。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
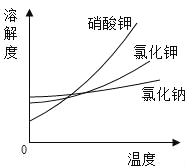
黄冈海淀全程培优测试卷系列答案【题目】某校化学兴趣小组欲探究 CO2 与 NaOH 溶液反应后的溶质组成。
(查阅资料)20℃时,几种物质在水中的溶解度(S):
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 | NaOH |
S/g | 21.5 | 9.6 | 0.165 | 3.89 | 109 |
(实验探究Ⅰ)
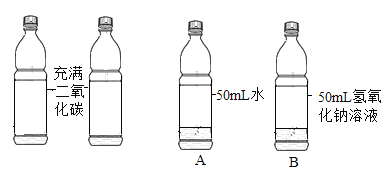
实验一:取两只充满 CO2 的矿泉水瓶,分别加入50mL 的水和等体积的 NaOH 溶液,立即拧紧瓶盖, 实验如图,充分振荡。瓶子变瘪程度 A______B(填 “>”“=”“<”)。
实验二:验证 B 瓶中反应生成了 Na2CO3:取少量 B 瓶中的溶液,滴加过量 BaCl2 的溶液,有白色沉淀生成,静置。
(1)该反应的化学方程式为______。
(2)实验中不宜将 BaCl2 溶液换成 CaCl2 溶液,原因是______。
实验三:取少量实验二中的上层清液,滴入几滴酚酞。
(3)溶液变红色。说明清液中还有 NaOH。
(4)实验二中必须加入过量的 BaCl2 溶液,理由是______。
(实验探究Ⅱ)
(查阅资料)
(1)本实验条件下,NaOH 溶液、Na2CO3 溶液和NaHCO3 溶液的 pH 分别约为 14.0、12.0和 8.5。
(2)将 CO2 通入少量的澄清石灰水中,溶液变浑浊,继续通 CO2 气体,浑浊逐渐消失, 其消失过程中发生的反应为:CaCO3 + H2O + CO2 =Ca(HCO3)2
(提出猜想)过量 CO2 与 NaOH 溶液反应后的溶质中还可能含有______(填化学式)。
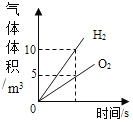
(进行实验)小明在老师的帮助下利用数字传感器完成了以下实验。室温(约 20℃)下, 将 8gNaOH 溶于 190g 水中,然后向其中持续通入二氧化碳气体,同时用数字传感器测定溶液的 pH 变化,所得数据如图 2 所示。
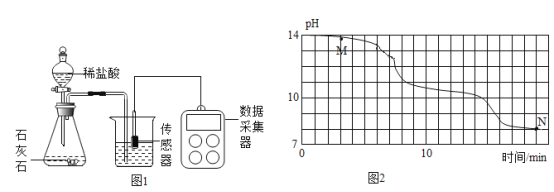
(得出结论)
(1)实验中,用“分液漏斗”而不用“长颈漏斗”的原因是______;
(2)根据资料和图像判断:M点溶质应为______(填化学式);
(反思交流)
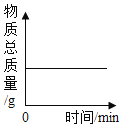
(1)经多次重复实验,所得实验结果基本一致。实验过程中发现 18min 后溶液的 pH 基本不再变化,则此时烧杯内______(填“有”或“无”)晶体析出,原因是______。
(2)待 pH 不再变化后,取适量溶液,向其中滴加几滴稀盐酸,立即产生气泡,该反应的化学方程式为_______。