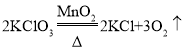��Ŀ����
����Ŀ��NaCl��Na2CO3��CaCl2�������ʵ��ܽ��������ͼ��ʾ������˵����ȷ���ǣ�������

A.40��ʱ��100g������Һ����������������CaCl2��Һ
B.��80���Na2CO3������Һ���µ�40�棬�ù����о�������
C.0��100�棬CaCl2������Һ��������������ʼ�մ���Na2CO3������Һ��������������
D.Ҫ��NaCl�ı�����Һ�л�ô������壬������ȴ�ȱ�����Һ�������ܼ����ַ���
���𰸡�C
��������
A��40��ʱ��100g������Һ�������������IJ�һ����CaCl2��Һ����Ϊ��֪����Һ�Ƿͣ���ѡ��˵������ȷ��
B����80���Na2CO3������Һ���µ�40�棬������̼�����ܽ�����ù���û�о�����������ѡ��˵������ȷ��
C��0��100�棬�Ȼ��Ƶ��ܽ�ȴ���̼���Ƶ��ܽ�ȣ����CaCl2������Һ��������������ʼ�մ���Na2CO3������Һ������������������ѡ��˵����ȷ��
D���Ȼ��Ƶ��ܽ�����¶ȱ仯Ӱ���С��Ҫ��NaCl�ı�����Һ�л�ô������壬Ӧ���������ܼ��ķ�������ѡ��˵������ȷ��
��ѡC��

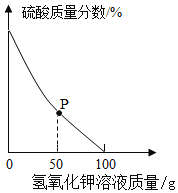
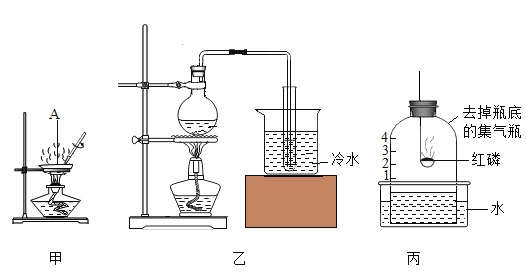
����Ŀ����ͼ��ʾ������ƿ�з�����ʯ����ҺȾ����ɫ�ĸ����ֽ������ A �������س���ͨ�������� X���±��е����ʼ�ʵ�������������Ӧ��ϵ����ȷ����
ѡ�� | ���� X | ����ʢ�ŵ���Һ�������� | �رբ� |
A | ��ʪ�Ļ���һ����̼�Ķ�����̼ | Ũ���� | ֽ������ɫ |
B | ����Ļ���һ����̼�Ķ�����̼ | ����������Һ | ֽ����Ϊ��ɫ |
C | ��ʪ�һ����Ȼ���Ķ�����̼ | ����������Һ | ֽ������ɫ |
D | �����һ����Ȼ���Ķ�����̼ | ����̼��������Һ | ֽ����Ϊ��ɫ |
A.AB.BC.CD.D
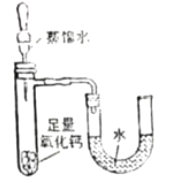
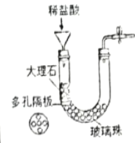
����Ŀ��U�ι���ʵ�����й㷺��Ӧ�á�
ʵ��һ:̽�����ӵ����� | ʵ���:��֤�����Ƶ����� | ʵ����: ̽�������Ļ��ǿ�� | ʵ����:ʵ������ȡ������̼ |
|
|
|
|
��ʵ��һ:˵�����Ӿ��е�������_____________��
��ʵ���:�۲쵽��������___________�� ��Ӧ�Ļ�ѧ����ʽΪ_________��
��ʵ����:��֤���������Fe>Cu>Ag��������__________����Ӧһ�����ȡ�����ֽ�������Һ�����ʵĴ��������_________________��
��ʵ����:Ϊ�˴ﵽ���濪���ã������ͣ����Ҫ��װ�õĸĽ���ʩ��___________________��
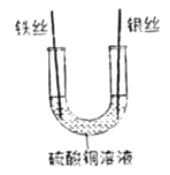
����Ŀ����ҵ���õ�ⱥ��ʳ��ˮ�ķ����Ʊ��ռNaOH����������Cl2������������������Ϊԭ������һϵ�л�����Ʒ����Ϊ�ȼҵ��ij��ѧ��ȤС��ͬѧ��ʵ���ҽ�������̽����
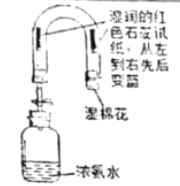
̽��һ����֤��ⱥ��ʳ��ˮ�IJ���
���������ϣ���1��������ͨ������³ʻ���ɫ����һ����ǿ�Ҵ̼�����ζ���ж����壻��2�������������Һ������Ӧ����ʹʪ��ĵ��۵⻯����ֽ������
��ʵ����֤����ͼ����ʾװ�ý���ʵ��̽��
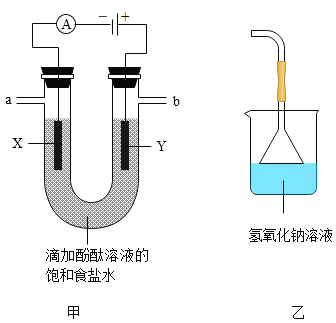
��ͨ��Դһ��ʱ��۲쵽X��Y�缫��Χ�������ݲ�������Һ����ɫ��Ϊ��ɫ����С�Թ���a���ռ����壬�ƽ��ƾ��ƻ��棬�ɿ�Ĵָ���������ı���������ʪ��ĵ��۵⻯����ֽ����b�ˣ���ֽ������
��ʵ�������
��1��a���ռ�����������_____��
��2����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ_____��
��3��b�˺�������װ�ã���װ��������������Һ��������_____��
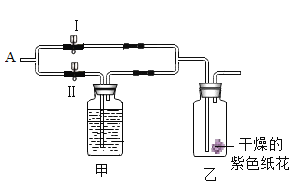
����չ���죩������ⱥ��ʳ��ˮʵ���У�������֮���ܷ�����ѧ��Ӧ��Ϊ��������Ϸ�����Ӧ����ҵ�ϳ������ӽ���Ĥ�����������Ʊ������õ�����Һ�����ᾧ����ռ
̽��������ҵ���������ռ��к�����Щ���ʣ�
��������裩
����һ��NaCl
�������Na2CO3
��������NaCl��Na2CO3
��ҵ���������ռ��п��ܺ���Na2CO3�������˲����������_____��
��ʵ��̽����
ʵ����� | ʵ������ | ʵ����� |
ȡ�����ռ���Ʒ���Թ��У�������ˮ�ܽ⣬���������ϡ���ᣬ�ٵμ�������������Һ | _____ | ��������ȷ |
����˼���ۣ�
��1��С��ͬѧ��Ϊ����ʵ���п���ϡ�������ϡ���ᣬС�겻ͬ�⣬С���������_____��
��2����ȥ�ռ���Һ��������̼���ƣ���ѡ�õ�ҩƷ��_____ �����ţ���
A CuCl2��Һ
B Ba(NO3)2��Һ
C Ba(OH)2��Һ
D KOH��Һ