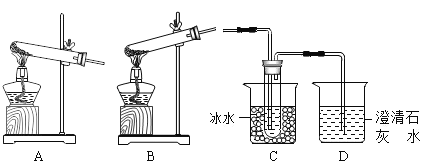
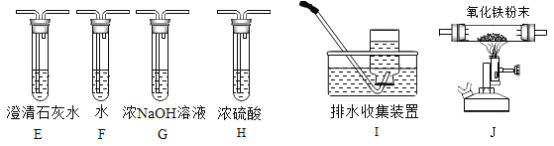
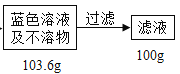
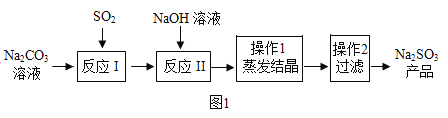
题目内容
【题目】氯化钠是一种重要的盐,也是人生理活动必需的物质.根据所学知识回答:
(1)要检验生理盐水中的氯化钠,应选用的试剂是___(填化学式)溶液。
(2)可用NaOH除去粗盐中可溶性杂质MgCl2,反应的化学方程式为___。
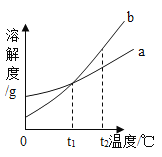
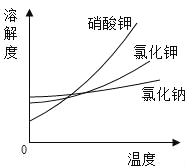
(3)如图为一些物质的溶解度曲线,其中氯化钠的溶解度曲线的特点是_______;采用冷却结晶的方法,能从氯化钠混合溶液中分离出来的物质有_____(从如图的物质中选填)。
【答案】AgNO3 2NaOH+MgCl2=Mg(OH)2↓+2NaCl 氯化钠的溶解度受温度的影响变化不大 硝酸钾
【解析】
(1)氯化钠中的氯离子能够与硝酸银中的银离子结合生成氯化银的白色沉淀,所以可用硝酸银溶液来检验生理盐水中的氯化钠,硝酸银的化学式为AgNO3,故填AgNO3。
(2)氢氧化钠与氯化镁反应生成氯化钠和氢氧化镁沉淀,故反应的化学方程式写为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl。
(3)由图可知,三种物质的溶解度均随温度升高而增大,但氯化钠的溶解度曲线比较平缓,表明氯化钠的溶解度受温度影响不大,故填氯化钠的溶解度受温度的影响变化不大;
冷却结晶适用于溶解度随温度升高而增大,且溶解度受温度影响较大的物质的结晶,三种物质中,硝酸钾的溶解度曲线最陡,说明硝酸钾的溶解度受温度影响最大,所以采用冷却结晶的方法,能从氯化钠混合溶液中分离出来的物质是硝酸钾,故填硝酸钾。

【题目】如图所示,在乙瓶中放入用石蕊溶液染成紫色的干燥的纸花,在 A 处缓缓地持续通入混合气体 X,下表中的物质及实验操作后的现象对应关系不正确的是
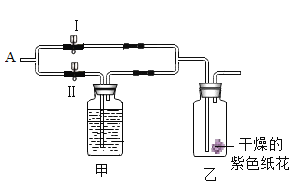
选项 | 气体 X | 甲中盛放的溶液(足量) | 关闭Ⅰ阀打开Ⅱ阀 |
A | 潮湿的混有一氧化碳的二氧化碳 | 浓硫酸 | 纸花不变色 |
B | 干燥的混有一氧化碳的二氧化碳 | 氢氧化钠溶液 | 纸花变为红色 |
C | 潮湿且混有氯化氢的二氧化碳 | 氢氧化钠溶液 | 纸花不变色 |
D | 干燥且混有氯化氢的二氧化碳 | 饱和碳酸氢钠溶液 | 纸花变为红色 |
A.AB.BC.CD.D