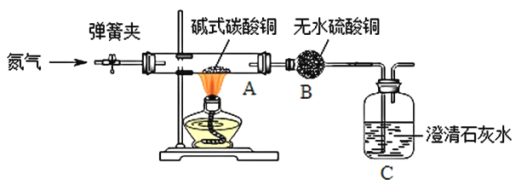
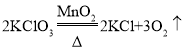题目内容
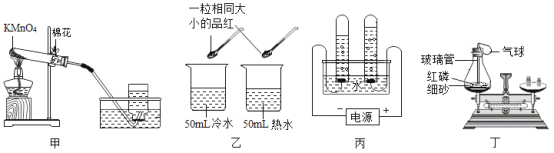
【题目】不能达到实验目的的是
A.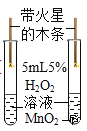 探究MnO2能加快H2O2反应速率
探究MnO2能加快H2O2反应速率
B. 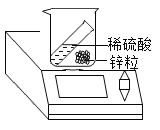 验证质量守恒定律
验证质量守恒定律
C.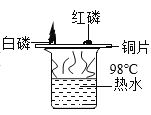 探究温度达到着火点是燃烧条件之一
探究温度达到着火点是燃烧条件之一
D. 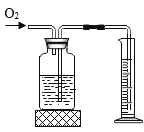 测量收集氧气的体积
测量收集氧气的体积
【答案】B
【解析】
A、加入二氧化锰的过氧化氢溶液,产生氧气速度快,所以会先复燃,因此可以探究MnO2能加快H2O2反应速率,选项A不符合题意;
B、锌与硫酸反应生成硫酸锌和氢气,装置敞口设置,不能收集气体,所以无法验证质量守恒定律,选项B符合题意;
C、根据白磷燃烧和红磷不燃烧,可以探究温度达到着火点是燃烧条件之一,选项C不符合题意;
D、氧气不易溶于水,从短口进气,压强增大,水从长口被压出,进入量筒,根据量筒测得水的体积,就可以得到氧气体积,因此可以测量收集氧气的体积,选项D不符合题意。故选B。

练习册系列答案
相关题目
【题目】如图所示,在乙瓶中放入用石蕊溶液染成紫色的干燥的纸花,在 A 处缓缓地持续通入混合气体 X,下表中的物质及实验操作后的现象对应关系不正确的是
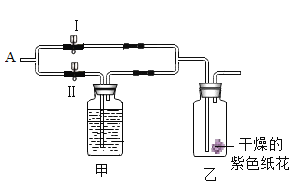
选项 | 气体 X | 甲中盛放的溶液(足量) | 关闭Ⅰ阀打开Ⅱ阀 |
A | 潮湿的混有一氧化碳的二氧化碳 | 浓硫酸 | 纸花不变色 |
B | 干燥的混有一氧化碳的二氧化碳 | 氢氧化钠溶液 | 纸花变为红色 |
C | 潮湿且混有氯化氢的二氧化碳 | 氢氧化钠溶液 | 纸花不变色 |
D | 干燥且混有氯化氢的二氧化碳 | 饱和碳酸氢钠溶液 | 纸花变为红色 |
A.AB.BC.CD.D