题目内容
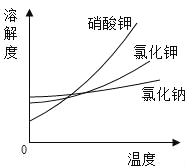
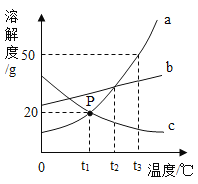
【题目】如图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
A.b的溶解度大于a的溶解度
B.t1℃时,将a、b两种物质的溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C.将t2℃时b的不饱和溶液降温至t1℃,不一定能得到b的饱和溶液
D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数
【答案】C
【解析】
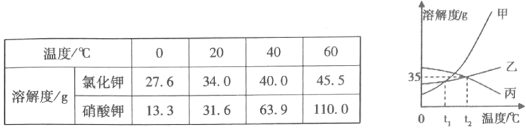
由溶解度曲线图可知,a、b的溶解度均随温度的升高而增大,b物质的溶解度受温度的影响较大。
A、比较溶解度大小时,必须在同一温度下,故A不正确;
B、t1℃时a、b的溶解度相等,t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量才相等,故B不正确;
C、将t2℃时b的不饱和溶液降温至t1℃,溶解度减小,可能没有晶体析出,不一定能得到b的饱和溶液,故C正确;
D、t2℃时,a的溶解度小于b的溶解度,但a溶液、b溶液的状态未知,若b溶液为很稀的溶液,t2℃时,a溶液的溶质质量分数可能大于b溶液的溶质质量分数,故D不正确。故选C。

 名题金卷系列答案
名题金卷系列答案【题目】Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。
实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | 温度/℃ | pH | 浓度/(mg·L-1) | |
H2O2 | Fe2+ | ||||
① | 为②③提供参照 | 25 | 3 | 204 | 16.8 |
② | 探究温度对降解反应速率的影响 | ________ | ________ | 204 | 16.8 |
③ | ________ | 25 | 10 | 204 | 16.8 |
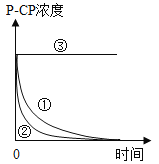
实验测得p-CP的浓度随时间变化的关系如图。
(2)实验发现,温度过高时,降解反应较难发生。请从Fenton法所用试剂的角度分析原因:__________。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:____________________。
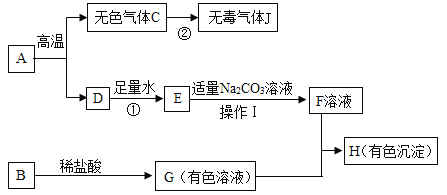
【题目】某校化学兴趣小组欲探究 CO2 与 NaOH 溶液反应后的溶质组成。
(查阅资料)20℃时,几种物质在水中的溶解度(S):
物质 | Na2CO3 | NaHCO3 | Ca(OH)2 | Ba(OH)2 | NaOH |
S/g | 21.5 | 9.6 | 0.165 | 3.89 | 109 |
(实验探究Ⅰ)
实验一:取两只充满 CO2 的矿泉水瓶,分别加入50mL 的水和等体积的 NaOH 溶液,立即拧紧瓶盖, 实验如图,充分振荡。瓶子变瘪程度 A______B(填 “>”“=”“<”)。
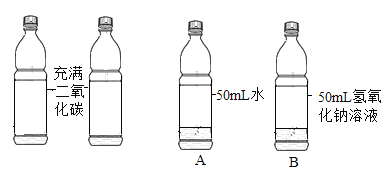
实验二:验证 B 瓶中反应生成了 Na2CO3:取少量 B 瓶中的溶液,滴加过量 BaCl2 的溶液,有白色沉淀生成,静置。
(1)该反应的化学方程式为______。
(2)实验中不宜将 BaCl2 溶液换成 CaCl2 溶液,原因是______。
实验三:取少量实验二中的上层清液,滴入几滴酚酞。
(3)溶液变红色。说明清液中还有 NaOH。
(4)实验二中必须加入过量的 BaCl2 溶液,理由是______。
(实验探究Ⅱ)
(查阅资料)
(1)本实验条件下,NaOH 溶液、Na2CO3 溶液和NaHCO3 溶液的 pH 分别约为 14.0、12.0和 8.5。
(2)将 CO2 通入少量的澄清石灰水中,溶液变浑浊,继续通 CO2 气体,浑浊逐渐消失, 其消失过程中发生的反应为:CaCO3 + H2O + CO2 =Ca(HCO3)2
(提出猜想)过量 CO2 与 NaOH 溶液反应后的溶质中还可能含有______(填化学式)。
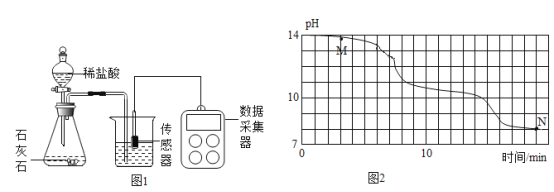
(进行实验)小明在老师的帮助下利用数字传感器完成了以下实验。室温(约 20℃)下, 将 8gNaOH 溶于 190g 水中,然后向其中持续通入二氧化碳气体,同时用数字传感器测定溶液的 pH 变化,所得数据如图 2 所示。
(得出结论)
(1)实验中,用“分液漏斗”而不用“长颈漏斗”的原因是______;
(2)根据资料和图像判断:M点溶质应为______(填化学式);
(反思交流)
(1)经多次重复实验,所得实验结果基本一致。实验过程中发现 18min 后溶液的 pH 基本不再变化,则此时烧杯内______(填“有”或“无”)晶体析出,原因是______。
(2)待 pH 不再变化后,取适量溶液,向其中滴加几滴稀盐酸,立即产生气泡,该反应的化学方程式为_______。