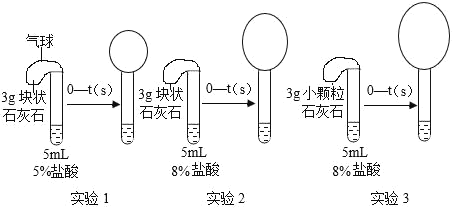
题目内容
【题目】在“宏观一微观”之间建立联系,是化学学科特有的思维方式。下图是某反应的微观示意图,下列有关该反应说法错误的是
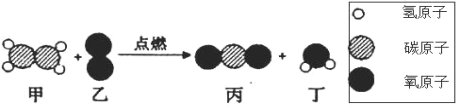
A. 反应前后原子个数不变B. 属于复分解反应
C. 生成的丙和丁的质量比为 22:9D. 反应前后分子个数不变
【答案】B
【解析】
A、由反应前后物质的微观构成可知,反应前后原子的种类和个数不变,故正确;
B、由化学反应的微观示意图可知,该反应的反应物是一种化合物和一种单质,不属于复分解反应,故错误。
C. 该反应的方程式为:C2H4+3O2![]() 2CO2+2H2O,生成的丙和丁的质量比为,2×44:2×18= 22:9,正确;
2CO2+2H2O,生成的丙和丁的质量比为,2×44:2×18= 22:9,正确;
D. 该反应的方程式为:C2H4+3O2![]() 2CO2+2H2O,观察可知,反应前后分子个数不变,正确。
2CO2+2H2O,观察可知,反应前后分子个数不变,正确。
故选:B。

 阅读快车系列答案
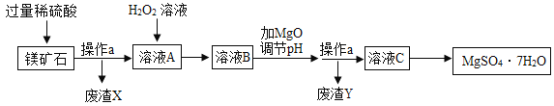
阅读快车系列答案【题目】MgSO47H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3,其它成分忽略)为原料制备MgSO47H2O的主要流程如图:
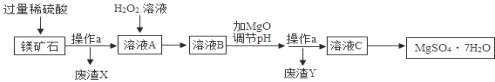
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3溶于稀硫酸的化学方程式为_____。
(2)为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 降低反应温度 C 用稀硫酸多次浸泡
(3)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为_____。
(4)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是_____。
(5)加氧化镁调节后溶液的pH范围是_____(用不等式表示)。
【题目】难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
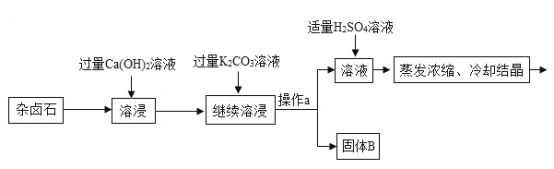
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是出去主要成分中的___;发生反应的化学方程式是___。
(2)操作a的名称是___。
(3)请写出固体B的两种主要成分___、___(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
a | 25 | 2.5 | 72.4 |
b | 40 | 2.5 | 86.55 |
c | 40 | 3 | 90.02 |
d | 60 | 3 | 91.98 |
e | 60 | 4 | 91.45 |
①上述实验的数据中,温度与K+浸取率的关系是___。
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是___℃和Ca(OH)2___g。
【题目】长久使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,用稀盐酸可以清除水垢.某学校化学课外兴趣小组的同学通过实验测定水垢中的碳酸钙的含量,将足量的稀盐酸加入到200g水垢中,同时测量3min内产生气体的质量,结果如下表:
时间/s | 0 | 30 | 50 | 90 | 120 | 150 | 180 |
质量/g | 0 | 30 | 50 | 60 | 80 | 66 | 66 |
试回答下列问题:
(1)表中有一个测量结果有较大的误差,这一点所对应的时间是_____s.
(2)请在如图的坐标系上,以反应时间为横轴,以产生气体的质量为纵轴,画出能够表明产生气体的质量,随反应时间变化规律._____
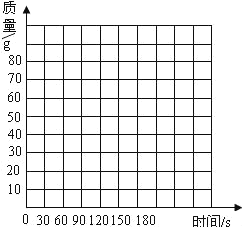
(3)计算该200g水垢中所含碳酸钙的质量及其质量分数._____