题目内容
【题目】漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂。漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应![]() ;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色。
(1)漂白粉是一种____________(填“纯净物”或“混合物”);
(2)HClO在常温下分解,反应为![]() 。某瓶HClO溶液放置一段时间后,溶液的pH值____________(填“增大”或“减小”或“不变”);
。某瓶HClO溶液放置一段时间后,溶液的pH值____________(填“增大”或“减小”或“不变”);
(3)在漂白粉中滴加盐酸,能加快漂白的速率。写出漂白粉中加入盐酸反应的化学方程式_______________。该反应的基本反应类型是____________反应;
【答案】混合物 减小 ![]() 复分解
复分解
【解析】
(1)因为漂白粉中含有次氯酸钙和氯化钙等物质,所以是一种混合物;
(2)HClO在常温下分解生成氯化氢和氧气,所以溶液中溶质由HClO变成HCl,盐酸酸性比次氯酸强,所以pH值减小;
(3)漂白粉中加入盐酸,次氯酸钙和盐酸反应生成次氯酸和氯化钙,化学方程式为:![]() ,该反应是由两种化合物相互交换成分生成两种化合物的反应,属于复分解反应。
,该反应是由两种化合物相互交换成分生成两种化合物的反应,属于复分解反应。

【题目】某实验小组的同学将一定量的稀盐酸加入到盛有 NaOH 溶液的小烧杯中,进行“酸碱中和反应”的探究活动
Ⅰ.写出上述实验的化学方程式_____
Ⅱ.反应后溶液中溶质是什么呢? 有同学猜想如下:①NaCl ②NaCl、NaOH ③NaCl、HCl ④有NaCl、HCl和NaOH
以上猜想你认为不合理的是_____
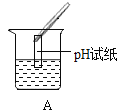
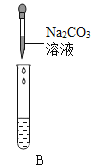
Ⅲ.为了验证上述合理的猜想,某同学取烧杯中的溶液少量于试管中,滴加几滴 CuSO4 溶液,无明显变化, 说明猜想_____不正确。另有同学利用烧杯中的溶液,并选用 pH 试纸、铜片、AgNO3 溶液、Na2CO3溶液,进行如下三个方案的探究
实验方案 | ①测溶液 pH | ②滴加 Na2CO3 溶液 | ③滴加 AgNO3 溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 试管中有气泡 | 产生白色沉淀 |
实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
经过上述实验可确定猜想_____是正确的;实验方案中错误的是_____(填实验方案标号);操作有错误的实验是_____(填实验操作标号)
Ⅳ.若在烧杯中加入 20g40%的氢氧化钠溶液,再逐滴加入稀盐酸,当滴入的稀盐酸质量为 25g 时恰好完全反应
①所用氢氧化钠溶液中溶质的物质的量为_____mol
②加入盐酸的质量分数是多少_____?(根据化学方程式计算,精确到 0.1%)
【题目】Fenton法常用于处理含难降解有机物的工业废水。其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分。现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。
实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或40℃(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | 温度/℃ | pH | 浓度/(mg·L-1) | |
H2O2 | Fe2+ | ||||
① | 为②③提供参照 | 25 | 3 | 204 | 16.8 |
② | 探究温度对降解反应速率的影响 | ________ | ________ | 204 | 16.8 |
③ | ________ | 25 | 10 | 204 | 16.8 |
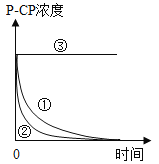
实验测得p-CP的浓度随时间变化的关系如图。
(2)实验发现,温度过高时,降解反应较难发生。请从Fenton法所用试剂的角度分析原因:__________。
(3)为测定不同时间内有机物降解的浓度,需在不同时间从反应器中取样,并使所取样品中的降解反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:____________________。