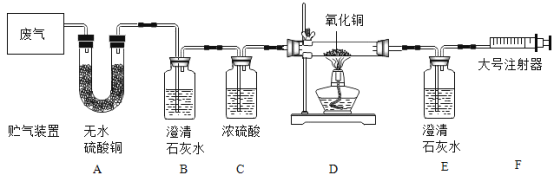
题目内容
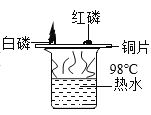
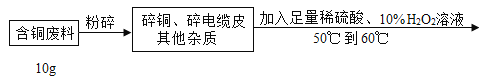
【题目】在电缆生产过程中,不可避免地会产生一定量的含铜废料(废料中电缆皮和其它杂质不参与化学反应也不溶于水)。某化学兴趣小组的同学得知这一情况后,想回收利用含铜废料,根据工业制备硫酸铜的流程做了如下实验:
查阅资料:Cu+H2SO4+H2O2![]() CuSO4+2H2O
CuSO4+2H2O
(1)将废料粉碎的目的是_____;过滤操作中玻璃棒的作用:_____。
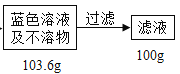
(2)滤液中硫酸铜的质量分数_____?
【答案】增大反应物间的接触面积,使反应充分 引流 16%
【解析】
![]()
(1)废料粉碎后表面积增大,增大了反应物间的接触面积,使反应速度加快,反应更加充分,故将废料粉碎的目的是增大反应物间的接触面积,使反应充分;过滤操作中玻璃棒的作用是引流。
(2)由图示可知蓝色溶液及不溶物是103.6g,经过滤后得到滤液100g,可知电缆皮和其它杂质不参与化学反应的物质是3.6g,铜的质量是![]()
设6.4g铜与硫酸、水反应生成硫酸铜的质量为x
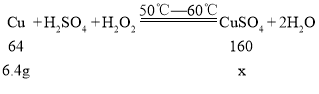
![]()
![]()
滤液中硫酸铜的质量分数为![]()
答:滤液中硫酸铜的质量分数为16%。

练习册系列答案
相关题目