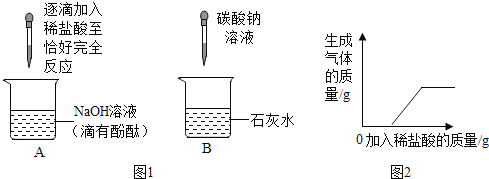
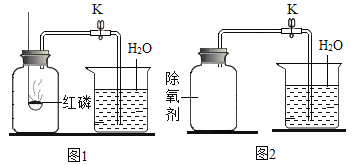
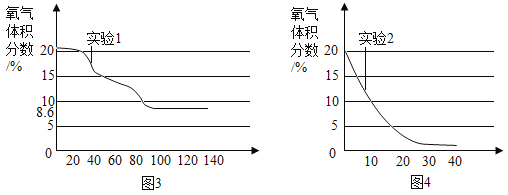
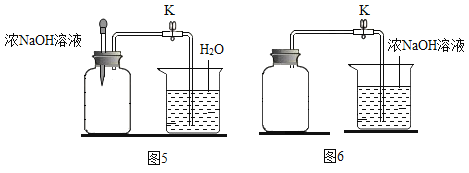
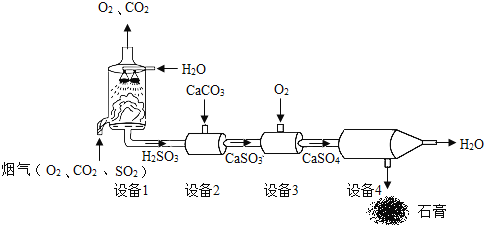
题目内容
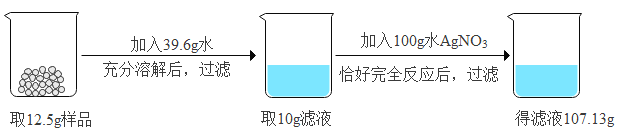
【题目】钛和钛合金被认为是21世纪的重要金属材料,他们具有很多优良的性能,如熔点高,密度小,可塑性好等。以钛铁矿(主要成分为FeTiO3,同时含有少量的Fe2O3、FeO等为原料制TiO2,再由TiO2制金属Ti的工艺流程如下:
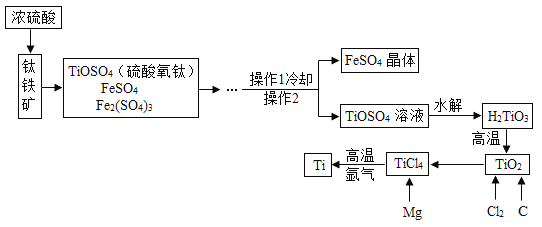
查阅资料:钛、镁在高温下能与空气中的氧气、二氧化碳等反应。
(1)硫酸氧钛(TiOSO4)中钛元素的化合价为_____。
(2)工艺流程中,水解属于_____变化(选填“物理”或“化学”)。
(3)工业上常在高温和氩气氛围中用TiCl4来制备金属Ti,其反应方程式为_____。其中氩气的作用是_____。
(4)TiO2 与焦炭、氯气在高温下反应制取TiCl4,该反应中氯气和碳的质量按71∶12 的比例恰好完全反应,反应的化学方程为_____。
【答案】+4 化学  做保护气,防止镁和钛在高温下与氧气、二氧化碳反应
做保护气,防止镁和钛在高温下与氧气、二氧化碳反应 
【解析】
(1)根据化合物中元素化合价的代数和为0,氧元素显-2价,硫酸根显-2价,设Ti元素的化合价为x,x+(-2)+(-2)=0,解得x=+4,故硫酸氧钛(TiOSO4)中钛元素的化合价为:+4。
(2)该工艺流程中,水解时TiOSO4变为H2TiO3,生成了新物质,属于化学变化。
(3)从流程中可知,在高温和氩气氛围中用Mg和TiCl4反应来制备金属Ti,其反应方程式为: 。因为钛、镁在高温下能与空气中的氧气、二氧化碳等反应,在氩气进行该反应,钛、镁就不会和空气中的氧气、二氧化碳等接触反应,所以反应中氩气的作用是:做保护气,防止镁和钛在高温下与氧气、二氧化碳反应。
。因为钛、镁在高温下能与空气中的氧气、二氧化碳等反应,在氩气进行该反应,钛、镁就不会和空气中的氧气、二氧化碳等接触反应,所以反应中氩气的作用是:做保护气,防止镁和钛在高温下与氧气、二氧化碳反应。
(4)TiO2 与焦炭、氯气在高温下反应制取TiCl4,根据该反应中氯气和碳的质量按71∶12 的比例恰好完全反应,计算出反应中氯气和碳的粒子个数比为1∶1,根据TiCl4的化学式,可以推出Cl2前的化学计量数是2,则C前的化学计量数也是2,因此生成物中碳、氧原子个数都是2,从而推出生成物是TiCl4和CO,反应的化学方程为: 。
。

【题目】某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。查阅资料可知 Mg、Mg3N2能发生如下反应:
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:
(1)连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是_____(填装置序号)。D装置中发生反应的化学方程式为_____。
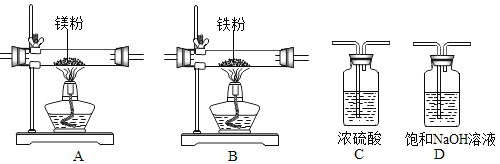
(2)通气后,应先点燃_____(填“A”或“B”)装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_____。
(3)设计一个实验,验证产物是氮化镁:
实验操作和实验现象 | 实验结论 |
_____ | 产物是氮化镁 |
(4)思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N2的质量,请给出合理的解释_____。