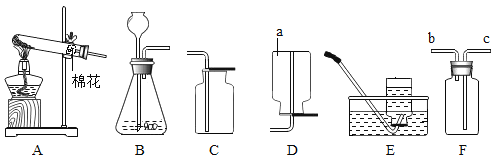
题目内容
【题目】NaCl是重要的资源,其应用与生产如下图所示。下列说法不正确的是
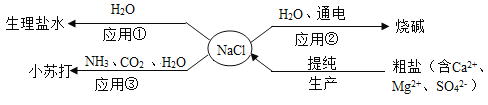
A.应用①操作的主要步骤为:计算、称量、溶解、装瓶、贴标签
B.应用②在制备烧碱的过程中,水参与了反应
C.应用③为提高产率应先通NH3,再通CO2,制备过程中还能得到一种化肥
D.生产中提纯粗盐时可依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤、蒸发
【答案】D
【解析】
A、应用①是用固体溶质配制一定质量分数的氯化钠溶液,操作的主要步骤为:计算、称量、溶解、装瓶、贴标签,选项A正确;
B、应用②是电解食盐水制备氢氧化钠。在这个过程中,食盐和水是反应物,生成物是氢氧化钠、氢气和氯气,水参与了反应,选项B正确;
C、应用③中先通NH3使食盐水呈碱性,有利于CO2的吸收,生成更多的碳酸氢钠,提高产率,该反应中同时生成氯化铵,氯化铵中含有氮元素,属于氮肥,选项C正确;
D、生产中提纯粗盐时依次加入过量的BaCl2、NaOH、Na2CO3溶液,再过滤,滤液中含有过量的NaOH、Na2CO3,最后蒸发得到的氯化钠固体中含有NaOH、Na2CO3,不能得到纯净的氯化钠,选项D不正确。故选D。

 互动英语系列答案
互动英语系列答案【题目】碳酸镁水合物是制备镁产品的中间体。
Ⅰ.(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1:
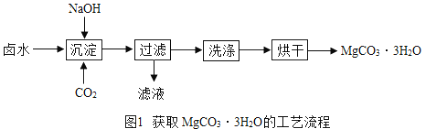
(1)沉淀过程得到了MgCO33H2O晶体和氯化钠的混合物,写出沉淀过程发生的化学反应方程式:________________________________________________。
(2)过滤需要用到的玻璃仪器有烧杯、玻璃棒和______,证明MgCO33H2O沉淀已洗涤干净的方法是,取最后一次洗涤液,_____________________________,说明已洗净。
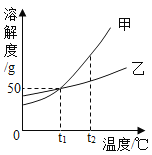
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示。
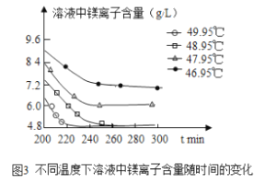
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为________,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
Ⅱ.(测定MgCO33H2O的纯度)
(查阅资料)
a.碱石灰是CaO与NaOH的固体混合物。
b.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
c.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24 MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
(实验步骤)
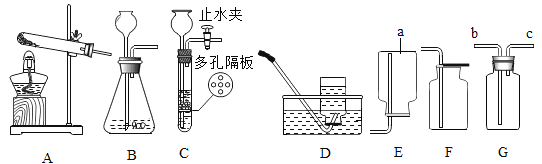
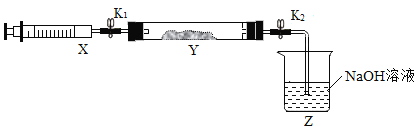
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
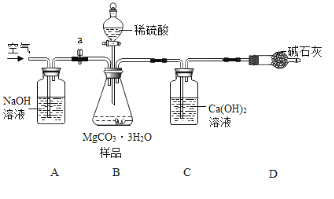

依据实验过程回答下列问题:
(1)实验结束后需持续缓缓通入空气,其作用为______________________________。
(2)C装置中反应生成CaCO3的化学方程式为_______________________;D中碱石灰的作用为_______________________________。
(3)下列各项措施中,能提高测定准确度的是_________(填标号)。
a在加入硫酸之前,应排净装置内的CO2气体
b为了缩短实验时间,快速滴加硫酸
c在B~C之间增添盛有浓硫酸的洗气装置
d在C装置左侧导管末端增添多孔球泡
e将C装置中澄清石灰水换成Ba(OH)2溶液
(4)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)。______
(5)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(O3)44H2O,则样品中MgCO33H2O的纯度___(填“偏大”“不变”或“偏小”)。