题目内容
【题目】为了探究酸碱中和反应,某小组取用氢氧化钠与稀盐酸进行实验,如图是稀盐酸和氢氧化钠反应发生过程中各项的变化,请
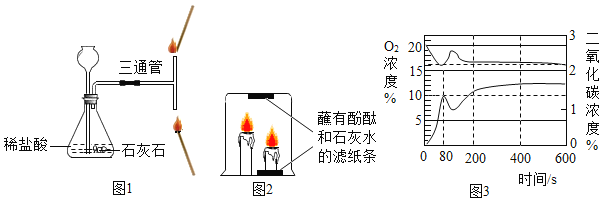
(1)请写出氢氧化钠和盐酸反应的化学方程式_____。
(2)如图一,用胶头滴管滴入一定量的溶液后,烧杯中的溶液恰好由红色变成无色,则滴管中的试剂是_____,此时对应图二中的_____(填“A”、“B”或“C”)点,继续滴加该试剂,可得到完整的图二、图三。
(3)根据图二的变化分析,可以看出中和反应是一个_____(填“放热反应”或“吸热反应”)。
(4)根据图三的变化分析,判定氢氧化钠和盐酸发生反应的依据是_____。
(5)图三C点溶液中含有的溶质是_____。
(6)在没有指示剂的情况下,下列试剂能帮助确定上述反应是否发生的是_____。
a.铁粉 b.AgNO3溶液 c.Na2CO3溶液
【答案】![]() 盐酸 B 放热反应 pH逐渐减小 NaCl、HCl ac
盐酸 B 放热反应 pH逐渐减小 NaCl、HCl ac
【解析】
(1)氢氧化钠和盐酸反应生成氯化钠和水,该反应的化学方程式为:![]() ;
;
(2)氢氧化钠显碱性,能使无色酚酞试液变红,用胶头滴管滴入一定量的溶液后,烧杯中的溶液恰好由红色变成无色,氢氧化钠与盐酸反应生成氯化钠和水,氯化钠和盐酸不能使无色酚酞试液变红,故烧杯中的溶液是氢氧化钠,滴管中的试剂是盐酸;
氢氧化钠与盐酸反应放热,恰好完全反应时,温度最高,故此时对应图二中的B点;
(3)由图二可以看出,随着反应的进行,温度逐渐升高,故中和反应是一个放热反应;
(4)由图三可以看出,随着反应的进行,溶液的pH逐渐减小,故判定氢氧化钠和盐酸发生反应的依据是:pH逐渐减小;
(5)氢氧化钠与盐酸反应生成氯化钠和水,C点时,pH<7,说明盐酸过量,故C点溶液中含有的溶质是:NaCl、HCl;
(6)a、一开始,氢氧化钠与铁粉不反应,无明显现象,氢氧化钠与稀盐酸反应生成氯化钠和水,反应过程中,加入铁粉,氯化钠与铁粉不反应,无明显现象,至稀盐酸过量,铁与稀盐酸反应生成氯化亚铁和氢气,有气泡产生,故能证明反应的发生,符合题意;
b、盐酸和氯化钠都能与硝酸银反应生成氯化银白色沉淀,无论反应是否发生,都有白色沉淀产生,故不能证明反应的发生,不符合题意;
c、将碳酸钠加入溶液中,一开始,氢氧化钠与碳酸钠不反应,随着盐酸的加入,盐酸先与氢氧化钠反应,待氢氧化钠完全反应后,盐酸再与碳酸钠反应生成氯化钠、二氧化碳和水,有气泡产生,故碳酸钠能证明反应的发生,符合题意。
故选ac。

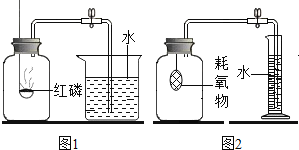
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | ______________ | ______________________________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是______________(填序号).

①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______________________________;她的改进措施是_______________________________________________________.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________,可以观察到的现象是________________________________________.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是____________(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为_______g.
③过滤、蒸发时都需用到的仪器是__________(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是________________.
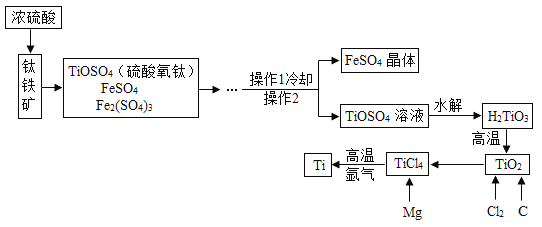
【题目】工业上常利用电石制乙炔气体![]() 时产生的灰浆和残渣制备化工原料
时产生的灰浆和残渣制备化工原料![]() 和超细
和超细![]() .
.
![]() 电石制乙炔气体
电石制乙炔气体![]() 时产生灰浆和残渣的过程如下:电石
时产生灰浆和残渣的过程如下:电石![]() 灰浆
灰浆![]() 残渣,其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式 ______,残渣中主要成分是
残渣,其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式 ______,残渣中主要成分是![]() 和 ______ .
和 ______ .
Ⅰ![]() 制备
制备![]() 的流程如图:
的流程如图:
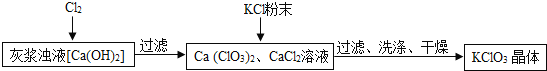
![]() 向灰浆浊液中通入
向灰浆浊液中通入![]() ,得到
,得到![]() 、
、![]() 溶液.反应中
溶液.反应中![]() 与
与![]() 的化学计量数分别为1和
的化学计量数分别为1和![]() 写出此反应的化学方程式 ______ .
写出此反应的化学方程式 ______ .
![]() 有关物质在常温下的溶解度如下:
有关物质在常温下的溶解度如下:
物质 |
|
|
| KCl |
溶解度 |
|
|
|
|
上述流程中加入KCl粉末,KCl与 ______ ![]() 填化学式
填化学式![]() 发生了复分解反应,得到
发生了复分解反应,得到![]() 晶体.你认为能得到
晶体.你认为能得到![]() 晶体的原因是 ______ .
晶体的原因是 ______ .
![]() 洗涤时,可选用下列洗涤剂 ______
洗涤时,可选用下列洗涤剂 ______ ![]() 填字母编号
填字母编号![]() .
.
A KCl饱和溶液![]() 冰水
冰水![]() 饱和
饱和![]() 溶液
溶液
Ⅱ![]() 制备超细
制备超细![]() 的流程如下
的流程如下![]() 注:加入
注:加入![]() 溶液的目的是溶解残渣中的难溶盐
溶液的目的是溶解残渣中的难溶盐![]() :
:
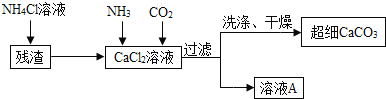
![]() 向
向![]() 溶液中通入两种气体,生成超细
溶液中通入两种气体,生成超细![]() 的化学方程式 ______
的化学方程式 ______ ![]() 检验
检验![]() 是否洗涤干净的方法是 ______ .
是否洗涤干净的方法是 ______ .
![]() 流程中溶液A可循环使用,其主要成分的化学式是 ______ .
流程中溶液A可循环使用,其主要成分的化学式是 ______ .