题目内容
【题目】某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。查阅资料可知 Mg、Mg3N2能发生如下反应:
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
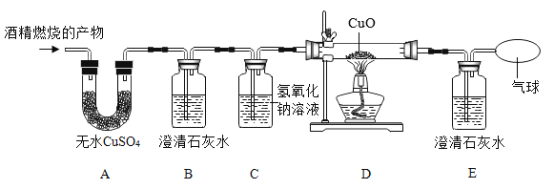
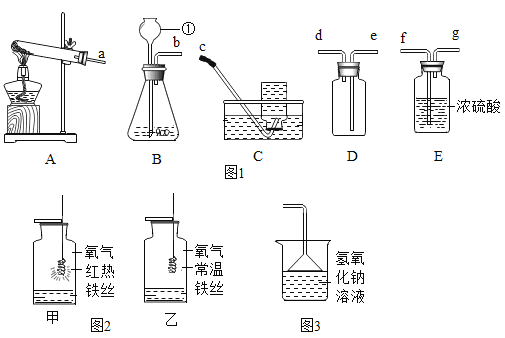
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:
(1)连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是_____(填装置序号)。D装置中发生反应的化学方程式为_____。
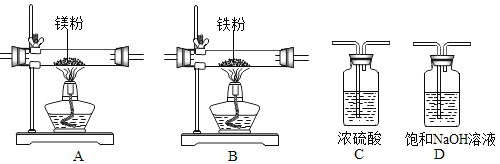
(2)通气后,应先点燃_____(填“A”或“B”)装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_____。
(3)设计一个实验,验证产物是氮化镁:
实验操作和实验现象 | 实验结论 |
_____ | 产物是氮化镁 |
(4)思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N2的质量,请给出合理的解释_____。
【答案】D→C→B→A CO2+2NaOH═Na2CO3+H2O B 制得的氮化镁不纯 将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝 O2比N2化学性质活泼
【解析】
(1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸作用是除去水蒸气,浓氢氧化钠是除去空气中二氧化碳,灼热的铁粉为了除去空气中氧气;除去水蒸气选用浓硫酸,除去氧气用能与空气中氧气反应的物质即可,除去二氧化碳用氢氧化钙溶液吸收,但要先除去二氧化碳再干燥然后除去氧气;二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O。
故答案为:D→C→B→A;CO2+2NaOH═Na2CO3+H2O。
(2)通气后,应向点燃B装置的酒精灯,如果同时点燃A、B装置的酒精灯,A没有排完空气就加热会让空气中的氧气、氮气和水与镁反应生成其他物质,制得的氮化镁不纯;
故填:B;制得的氮化镁不纯。
(3)依据氮化镁和水反应生成氨气,方程式为 Mg3N2+6H2O=3Mg(OH)2+2NH3↑,将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁;
故填:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝;
(4)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,因为O2比N2化学性质活泼。
故填:O2比N2化学性质活泼。

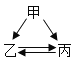
【题目】下列各组转化关系中的反应为初中化学常见的反应,其中的“→”表示某种物质可一步反应生成另一种物质。甲、乙、丙三种物质不符合对应“转化关系”的是( )
选项 | A | B | C | D | |
转化关系 |
|
|
|
| |
物质 | 甲 | H2O2 | C | CaCO3 | FeCl2 |
乙 | O2 | CO | CO2 | Fe | |
丙 | H2O | CO2 | Na2CO3 | Fe2O3 | |
A.AB.BC.CD.D