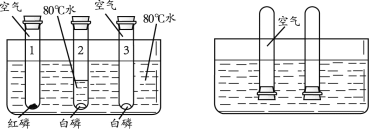
题目内容
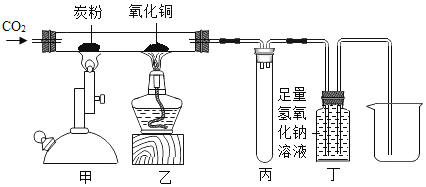
【题目】利用如图装置探究甲烷和氧化铜的反应。观察到A中CuO粉末由黑变红;B中CuSO4粉末(由于吸收水)由白变蓝;C中澄清石灰水变浑浊。下列叙述错误的是
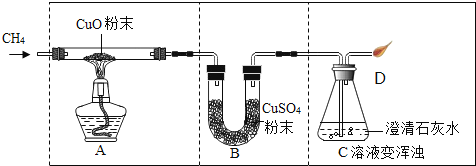
A.实验开始时,应先通甲烷气体,再点燃酒精灯
B.反应结束后,先熄灭A处酒精灯,可能会引起倒吸
C.推测A中反应方程式CH4+4CuO![]() CO2+2H2O+4Cu
CO2+2H2O+4Cu
D.装置A中,发生了置换反应
【答案】D
【解析】
A中CuO粉末由黑变红,生成了铜;B中CuSO4粉末(由于吸收水)由白变蓝,生成了水;C中澄清石灰水变浑浊,生成了二氧化碳,甲烷和氧化铜加热生成铜、二氧化碳和水。
A、实验开始时,应先通甲烷气体,排空空气,再点燃酒精灯,以免发生爆炸,故A正确;
B、反应结束后,先熄灭A处酒精灯,可能会引起倒吸,故B正确;
C、A中CuO粉末由黑变红,生成了铜;B中CuSO4粉末(由于吸收水)由白变蓝,生成了水;C中澄清石灰水变浑浊,生成了二氧化碳,推测A中反应方程式CH4+4CuO![]() CO2+2H2O+4Cu,故C正确;
CO2+2H2O+4Cu,故C正确;
D、装置A中,反应物是两种化合物,没有发生置换反应,故D不正确。故选D。

【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于如表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 20 | 17.4 |
第2次 | 20 | 14.8 |
第3次 | 20 | 12.2 |
第4次 | 20 | 12 |
第5次 | 20 | m |
试回答下列问题:
(1)上述表格中m的值为_____;
(2)黄铜样品中锌的质量为_____;
(3)所用稀硫酸中硫酸的质量分数是_____。
【题目】某兴趣小组探究影响H2O2分解速率的因素。下列是有关探究过程的两次实验:
(1)兴趣小组用如下图a装置探究影响H2O2分解速率的因素,实验设计方案见下表,请帮助完成(所有空均需填满)。
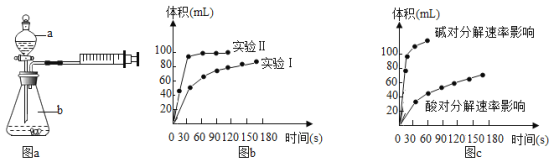
实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
实验Ⅱ | _________ | 25 | _________ | 10ml 5%H2O2 |
①反应的化学方程式为_____________。
②实验得出的数据如图b,由实验得出的数据可知:浓度越大,H2O2分解速率______________。
(2)兴趣小组又探究了酸、碱对H2O2分解速率的因素,实验得出的数据如图c。请你在相同条件下,______(填“酸”或“碱”)存在的情况下放出气体速率较快;你得出此结论的理由是____________。