题目内容
【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于如表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 20 | 17.4 |
第2次 | 20 | 14.8 |
第3次 | 20 | 12.2 |
第4次 | 20 | 12 |
第5次 | 20 | m |
试回答下列问题:
(1)上述表格中m的值为_____;
(2)黄铜样品中锌的质量为_____;
(3)所用稀硫酸中硫酸的质量分数是_____。
【答案】12 8g 19.6%
【解析】
根据前三次固体都是减少2.6g而第四次只减少了0.2g,说明此时锌已经完全反应,继续加入硫酸固体不减少,所以m=12g,锌的质量为20g﹣12g=8g。结合每20g稀硫酸和2.6g锌恰好完全反应求算所用稀硫酸中硫酸的质量分数。
(1)根据前三次固体都是减少2.6g而第四次只减少了0.2g,说明此时锌已经完全反应,继续加入硫酸固体不减少,所以m=12g;
(2)由上分析可知锌的质量为20g﹣12g=8g;
(3)由上分析可知每20g稀硫酸和2.6g锌恰好完全反应。设所用稀硫酸中硫酸的质量分数为x
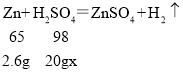
![]()
x=19.6%
答:(1)上述表格中m的值为 12;
(2)黄铜样品中锌的质量为 8g;
(3)所用稀硫酸中硫酸的质量分数是 19.6%。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目