题目内容
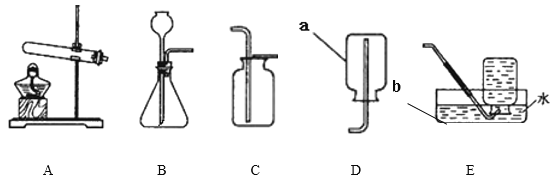
【题目】下面是几种实验室制取气体的发生装置和收集装置。
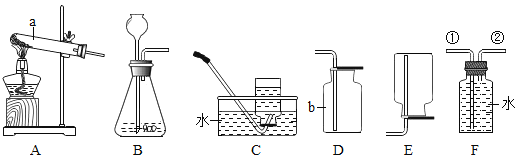
(1)写出图中仪器a、b的名称a_____;b_____。
(2)梅梅同学用高锰酸钾制取一瓶干燥的氧气时用A装置作为发生装置,其中A装置的试管口要略向下倾斜的目的是_____,你认为她应该选择的收集装置是_____(填字母标号)。写出反应的文字或符号表达式_____。二氧化碳能溶于水,且密度比空气大,实验室常用固体石灰石与液体稀盐酸在常温下反应来产生二氧化碳气体。实验室制取二氧化碳应选择的装置为_____。(填序号)
(3)F图是某学生设计的一种有洗气、贮气等用途的装置。当用排水集气法收集氢气时,瓶内先装满水,气体从_____(填“①”或“②”)处导管通入。
【答案】试管 集气瓶 防止冷凝水回流,骤冷而使试管炸裂 C或D 高锰酸钾![]() 锰酸钾+二氧化锰+氧气或KMnO4
锰酸钾+二氧化锰+氧气或KMnO4![]() K2MnO4+MnO2+O2 BD ②
K2MnO4+MnO2+O2 BD ②
【解析】
(2)加热试管内药品时,若试管受热不均,则试管可能会炸裂,据此分析试管倾斜的原因;气体的收集方法与气体的水溶性以及是否与空气成分能够反应、与空气密度的相对大小有关,据此分析气体的收集装置以及收集方法;
(1)根据图中仪器a、b的形状和用途可知,a的名称是试管,b的名称是集气瓶;
(2)利用A装置制取氧气时,高锰酸钾药品中可能含有水分,加热时产生的水蒸气会在试管口冷凝为小水滴,为了防止小水滴沿试管内壁倒流到试管底部导致试管受热不均而炸裂,因此A装置的试管口需要略向下倾斜;氧气不易溶于水,因此可以采用排水法收集,则可以选用装置C作为收集装置,氧气的密度大于空气密度,因此可以采用向上排空气法收集,则可以选用D作为收集装置,即可以选择的收集装置有:C或D;高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应条件为加热,则该反应的文字表达式为:高锰酸钾![]() 锰酸钾+二氧化锰+氧气,符号表达式为KMnO4
锰酸钾+二氧化锰+氧气,符号表达式为KMnO4![]() K2MnO4+MnO2+O2;实验室采用大理石或石灰石与稀盐酸反应制取二氧化碳,该反应的反应物为固体和液体,反应不需要加热,因此该反应的发生装置为固液常温下,则发生装置选B,由于二氧化碳可溶于水,密度比空气密度大,因此收集二氧化碳的方法为向上排空气法,则收集二氧化碳的装置为D,即实验室制取二氧化碳应选择的装置为BD,
K2MnO4+MnO2+O2;实验室采用大理石或石灰石与稀盐酸反应制取二氧化碳,该反应的反应物为固体和液体,反应不需要加热,因此该反应的发生装置为固液常温下,则发生装置选B,由于二氧化碳可溶于水,密度比空气密度大,因此收集二氧化碳的方法为向上排空气法,则收集二氧化碳的装置为D,即实验室制取二氧化碳应选择的装置为BD,
(3)由于氢气难溶于水,通过F利用排水法收集氢气时,氢气应从短管(②口)通入,液面上方气压逐渐增大,则瓶内的水从①口排出,从而收集到一瓶氢气。

 名校课堂系列答案
名校课堂系列答案【题目】化学课上,张老师用排水法收集了一瓶氧气,然后将一根带火星的木条伸入瓶中,结果木条复燃了。
爱动脑筋的小听同学思考:空气中的氧气不能使带火星的木条复燃,而老师收集的氧气却可以,于是提出 了问题:是否只有纯氧才能使带火星的木条复燃呢?张老师告诉同学们:“并不是只有纯氧才能使带火星的 木条复燃”。
(提出问题)究竟气体中氧气的体积分数达到多少才能使带火星的木条复燃?
(探究准备)
(1)兴趣小组的同学先复习了实验室制取氧气的三种方法,最终一致同意选用过氧化氢制取氧气,他们的理由是____(写两条)。
(2)讨论如何获得不同体积分数的氧气。请你帮助他们设计一种收集氧气体积分数为 80%、空气体积分 数为 20%的混合气体的方法:____。
(实验步骤)
(1)按如图装置组装仪器,检查装置的气密性。
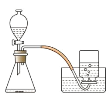
(2)装入药品,分别用 100 毫升的集气瓶收集 5 瓶不同体积分数的氧气。
(3)分别将带火星的木条伸入 5 个集气瓶中,观察实验现象。
(4)记录数据如下表并请你将.表.格.填.写.完.整.。
(记录现象) 实验的数据和现象见下表(已知空气中氧气的体积分数为 21%)。
集气瓶 编号 | 瓶内预装水体积 /mL | 充入氧气体积 /mL | 瓶内空气体积 /mL | 木条能不能 复燃 |
① | 10 | 10 | 90 | 不能 |
② | 20 | 20 | 80 | 不能 |
③ | 30 | ____ | 70 | 不能 |
④ | 40 | 40 | 60 | 能 |
⑤ | 50 | 50 | 50 | ____ |
(讨论与交流)
以上实验刚结束,小听同学脱口而出:氧气的体积分数达到 40%就能使带火星的木条复燃。这个结论遭 到了小语同学的反驳,她反驳的理由是_____。
(反思与总结)
张老师提示,为了使实验结果更加精确,还需要进一步探究,同学们又积极开展探究,部分实验记录如 下表,他们最终得出:混合气体中氧气的体积分数只要达到_____%(保留两位小数)就能使带火星的 木条复燃。
集气瓶 编号 | 瓶内预装水体积 /mL | 充入氧气体积 /mL | 瓶内空气体积 /mL | 木条能不能 复燃 |
… | … | … | … | … |
… | 35 | 35 | 65 | 刚好能 |
【题目】一种名为“污渍爆炸盐”的洗涤产品能高效去除衣物上的顽固污渍,某校化学研究性学习小组的同学在老师的指导下对该产品开展了以下探究活动。
(查阅资料)“污渍爆炸盐”的主要成分是过碳酸钠(相对分子质量为122),它是一种白色固体粉末,易溶于水且能与水反应生成一种产物碳酸钠(Na2CO3)和另一种强氧化性的物质,具有去污、杀菌的作用,也是当前使用最为广泛的洗涤剂助剂之一;过碳酸钠具有无毒,无臭,遇热易分解,与可燃物接触易起火等性质。
(实验探究)过碳酸钠的化学组成是什么?为探究过碳酸钠的化学组成,同学们设计了以下实验,请按要求完成表格中的空格内容:
序号 | 实验步骤 | 实验现象 | 实验分步结论(或解释) | |
① | 向盛有过碳酸钠固体的试管中加入适量的水 | 固体溶解 | _____。 | |
② | 向序号①的所得溶液中加入适量的二氧化锰粉末 | 有大量气泡产生 | ||
③ | 将带火星的木条置于试管口 | 木条复燃 | 序号②试管中产生的气体是_____;过碳酸钠溶于水能生成_____(填化学式)。 | |
实验 小结 | 过碳酸钠的化学式是_____;过碳酸钠与水反应的化学方程式是_____。 | |||
(反思拓展)(1)根据过碳酸钠的化学性质,过碳酸钠可作为医院、公共场所的_____;
(2)洗涤产品“污渍爆炸盐”的保存方法是:_____。