题目内容
【题目】人类的生活、生产离不开金属。大自然向人类提供了丰富的金属矿物资源,人类每年提取量较大的金属是铁、铝、铜。
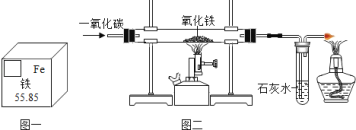
(1)根据铁在元素周期表中的信息(如图一),下列说法正确的是____。
A.方框内的数值即核内中子数为 26
B.铁的相对原子质量为 55.85g
C.铁元素在化学反应中易失去电子
D.铁离子的符号为 Fe2+
(2)防止铁制品锈蚀的措施有______(填一条)
(3)如图二所示是实验室用 CO 还原氧化铁的反应,玻璃管内的现象是_____,右端酒精灯的作用的是____。
(4)请你设计简单的实验,证明锌、铁、铜的活动性顺序,写出实验步骤、现象和结论。
实验步骤 | 实验现象 | 实现结论 |
________ | _______ | _______ |
(5)黄铜是铜锌合金,为测定某黄铜样品中铜的含量,取该黄铜样品 10g,放入足量稀盐酸中充分反应后,收集到 0.2g 氢气,请计算黄铜样品中铜的质量分数_______。(写出解题步骤)
【答案】C 在铁制品表面涂抹油漆(合理即可) 红色固体变黑 处理尾气 分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象 浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化 金属活动性顺序: Zn>Fe>Cu 35%
【解析】
(1)A、方框内的数值即核内质子数为 26,故不符合题意;
B、铁的相对原子质量为 55.85,故不符合题意;
C、铁元素是金属元素,最外层电子数小于4,在化学反应中易失去电子,故符合题意;
D、铁离子的符号为Fe3+,故不符合题意
(2) 防止铁制品锈蚀的措施有在铁制品表面涂抹油漆或烤瓷等(合理即可);
(3) 如图二所示是实验室用CO还原氧化铁的反应,玻璃管内的现象是红色固体变黑;
右端酒精灯的作用的是处理尾气;
(4) 分别取少量硫酸铜溶液、硫酸锌溶液于两支试管中,将铁丝分别浸入两溶液中,观察现象(或分别取少量硫酸亚铁溶液于两支试管中,分别将铜丝、锌粒浸入两溶液中,观察现象);
浸入硫酸铜溶液中的铁丝表面出现红色固体,溶液由蓝色逐渐变为浅绿色;浸入硫酸锌溶液的铁丝无明显变化(铜丝浸入硫酸亚铁中无明显变化,锌粒浸入硫酸亚铁溶液中溶液由浅绿色变为无色);
金属活动性顺序:Zn>Fe>Cu;
(5)解:设黄铜中锌的质量为x
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.2g
![]()
x=6.5g
Cu%=![]() X100%=35%
X100%=35%
答:黄铜样品中铜的质量分数为35%

【题目】一定条件下,一密闭容器内发生某反应,测得反应前后各物质质量如表所示。下列说法正确的是![]()
![]()
物质质量/g | CO2 | O2 | H2O | R |
反应前 | 1 | 40 | 11 | 4 |
反应后 | X | 24 | 20 | 0 |
A. 该反应属于置换反应
B. X的值为11
C. R是由碳、氢两种元素组成的化合物
D. R是由碳、氢、氧三种元素组成的化合物