题目内容
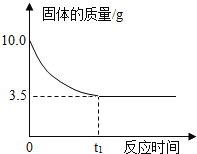
【题目】将15.8 g高锰酸钾放在试管里加热制取氧气,加热到不再产生气体为止。请回答:
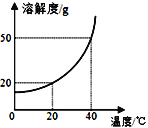
(1)反应后剩余固体物质的质量________高锰酸钾的质量。(填“大于”“小于”“等于”)。推断的依据是__________________。
(2)剩余固体物质中含有的物质是________,各是________克?
【答案】⑴小于⑵质量守恒定律⑶锰酸钾和二氧化锰⑷锰酸钾是9.85g,二氧化锰是4.35g。
【解析】(1)反应后剩余固体物质的质量小于高锰酸钾的质量,生成了气体氧气;推断的依据是质量守恒定律,任何一个化学反应都必然遵循质量守恒定律。
(2)高锰酸钾加热完全反应后生成固体是锰酸钾和二氧化锰,反应后剩余固体物质中含有锰酸钾和二氧化锰。
解:设剩余的固体中含K2MnO4的质量为x,含MnO2的质量为y
2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 197 87
15.8 x y
![]() =
=![]() , x=9.85 g。
, x=9.85 g。
![]() =
=![]() , y=4.35 g。
, y=4.35 g。
答:剩余固体物质中含有K2MnO49.85克,含MnO24.35克。
点睛∶任何一个化学反应都必然遵循质量守恒定律。高锰酸钾加热完全反应后生成固体是锰酸钾和二氧化锰。

 阅读快车系列答案
阅读快车系列答案【题目】人类的生活、生产离不开金属。大自然向人类提供了丰富的金属矿物资源,人类每年提取量较大的金属是铁、铝、铜。
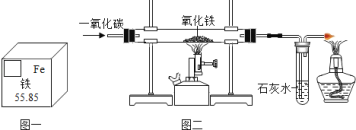
(1)根据铁在元素周期表中的信息(如图一),下列说法正确的是____。
A.方框内的数值即核内中子数为 26
B.铁的相对原子质量为 55.85g
C.铁元素在化学反应中易失去电子
D.铁离子的符号为 Fe2+
(2)防止铁制品锈蚀的措施有______(填一条)
(3)如图二所示是实验室用 CO 还原氧化铁的反应,玻璃管内的现象是_____,右端酒精灯的作用的是____。
(4)请你设计简单的实验,证明锌、铁、铜的活动性顺序,写出实验步骤、现象和结论。
实验步骤 | 实验现象 | 实现结论 |
________ | _______ | _______ |
(5)黄铜是铜锌合金,为测定某黄铜样品中铜的含量,取该黄铜样品 10g,放入足量稀盐酸中充分反应后,收集到 0.2g 氢气,请计算黄铜样品中铜的质量分数_______。(写出解题步骤)