题目内容
【题目】一定条件下,一密闭容器内发生某反应,测得反应前后各物质质量如表所示。下列说法正确的是![]()
![]()
物质质量/g | CO2 | O2 | H2O | R |
反应前 | 1 | 40 | 11 | 4 |
反应后 | X | 24 | 20 | 0 |
A. 该反应属于置换反应
B. X的值为11
C. R是由碳、氢两种元素组成的化合物
D. R是由碳、氢、氧三种元素组成的化合物
【答案】C
【解析】
根据质量守恒定律,参与化学反应的各物质质量总和等于反应后生成的各物质质量总和,故X=1g+40g+11g+4g-24g-20g=12g,因为四种物质中R和氧气质量减小,所以是反应物,二氧化碳和水质量增加,为生成物。
A、因为该反应二氧化碳和水为生成物,且两者都是化合物,没有单质生成,不符合置换反应的定义,故选项错误;
B、根据分析可知,X=12g,故选项错误;
C、根据质量守恒定律,反应前后元素种类不变,反应后生成物是水和二氧化碳,即含有碳、氢、氧元素,故可以看出R中一定含有碳、氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较。生成的水中氧元素的质量为(20-11)g×![]() =8g,生成二氧化碳中氧元素的质量=(12-1)g×
=8g,生成二氧化碳中氧元素的质量=(12-1)g×![]() =8g,两者的质量和为16g,而参加反应的氧气的质量=40g-24g=16g,所以可判断R中一定不含有氧元素,即R是由碳、氢两种元素组成的化合物,故选项正确;
=8g,两者的质量和为16g,而参加反应的氧气的质量=40g-24g=16g,所以可判断R中一定不含有氧元素,即R是由碳、氢两种元素组成的化合物,故选项正确;
D、由以上分析知,R是由碳、氢两种元素组成的化合物,故选项错误。故选C。

【题目】人类的生活、生产离不开金属。大自然向人类提供了丰富的金属矿物资源,人类每年提取量较大的金属是铁、铝、铜。
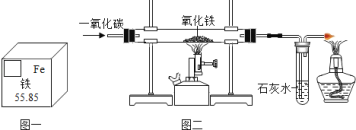
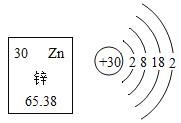
(1)根据铁在元素周期表中的信息(如图一),下列说法正确的是____。
A.方框内的数值即核内中子数为 26
B.铁的相对原子质量为 55.85g
C.铁元素在化学反应中易失去电子
D.铁离子的符号为 Fe2+
(2)防止铁制品锈蚀的措施有______(填一条)
(3)如图二所示是实验室用 CO 还原氧化铁的反应,玻璃管内的现象是_____,右端酒精灯的作用的是____。
(4)请你设计简单的实验,证明锌、铁、铜的活动性顺序,写出实验步骤、现象和结论。
实验步骤 | 实验现象 | 实现结论 |
________ | _______ | _______ |
(5)黄铜是铜锌合金,为测定某黄铜样品中铜的含量,取该黄铜样品 10g,放入足量稀盐酸中充分反应后,收集到 0.2g 氢气,请计算黄铜样品中铜的质量分数_______。(写出解题步骤)
【题目】化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制取氧气,该反应的化学表达式为________。某次实验时偶然发现制得的气体有刺激性气味,这一现象引起了同学们的兴趣,于是在老师的指导下对该气体成分进行探究。
【提出问题】氯酸钾与二氧化锰混合加热后产生的气体成分是什么?
【查阅资料】
①氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
②氯气(Cl2)是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝。
【猜想假设】
猜想一:该气体为O2;猜想二:该气体为______;猜想三:该气体为O2和Cl2的混合物。
【实验探究】
序号 | 操作 | 现象 | 结论 |
方案Ⅰ | 用排水集气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | 木条复燃, 淀粉碘化钾试纸不变色 | 猜想_______成立 |
方案Ⅱ | 向上排空气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | 木条______, 淀粉碘化钾试纸为___色 | 猜想三成立 |
【反思评价】
为什么两种方案得出的结论不一致?哪个是正确的?
①同学:方案Ⅰ结论不正确,其操作不合理,不合理之处是__________。
②老师:不需要进行实验,就能排除猜想一,理由是__________。
【拓展应用】
实验结束后,该组同学准备回收固体剩余物中的不溶物二氧化锰,实验的主要步骤为:①溶解、②________、③洗涤干燥。步骤②中玻璃棒的作用是_________。