题目内容
【题目】如图是初中化学课本中的两个演示实验,请回答下列问题。
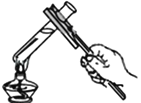
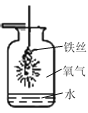
(1)如图是“铁丝在氧气中燃烧”的实验。实验现象是铁丝剧烈燃烧,_____,放出热量,生成黑色固体,集气瓶中水的作用是____。
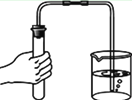
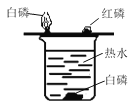
(2)如图是“探究可燃物燃烧条件”的实验。观察到铜片上白磷燃烧、红磷不燃烧,由此可知:可燃物燃烧的条件之一是________,热水中白磷不燃烧的原因是___________,要使其燃烧的方法是_________。
【答案】火星四射 防止生成的熔化物炸裂瓶底 温度达到着火点 热水阻隔白磷与氧气的接触 用导管对准水中的白磷,通入少量O2(合理给分)
【解析】
(1)铁丝在氧气中燃烧,剧烈燃烧,火星四射,放出热量,生成黑色固体。铁丝在氧气中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水;
(2)铜片上白磷燃烧、红磷不燃烧,是因为温度没有达到红磷的着火点,达到了白磷的着火点,说明可燃物燃烧的条件之一是温度要达到着火点;热水中白磷不燃烧的原因是没有与氧气接触;要使其燃烧,可采用用导管对准水中的白磷,通入少量O2(合理即可)。

【题目】人类的生活、生产离不开金属。大自然向人类提供了丰富的金属矿物资源,人类每年提取量较大的金属是铁、铝、铜。
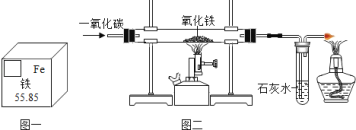
(1)根据铁在元素周期表中的信息(如图一),下列说法正确的是____。
A.方框内的数值即核内中子数为 26
B.铁的相对原子质量为 55.85g
C.铁元素在化学反应中易失去电子
D.铁离子的符号为 Fe2+
(2)防止铁制品锈蚀的措施有______(填一条)
(3)如图二所示是实验室用 CO 还原氧化铁的反应,玻璃管内的现象是_____,右端酒精灯的作用的是____。
(4)请你设计简单的实验,证明锌、铁、铜的活动性顺序,写出实验步骤、现象和结论。
实验步骤 | 实验现象 | 实现结论 |
________ | _______ | _______ |
(5)黄铜是铜锌合金,为测定某黄铜样品中铜的含量,取该黄铜样品 10g,放入足量稀盐酸中充分反应后,收集到 0.2g 氢气,请计算黄铜样品中铜的质量分数_______。(写出解题步骤)