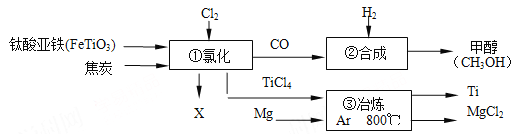
题目内容
【题目】以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
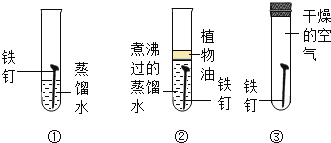
(1)实验时需将镁条进行打磨,其目的是_______________。
(2) 反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”)。
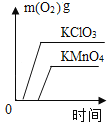
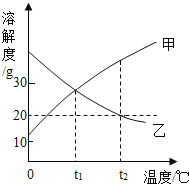
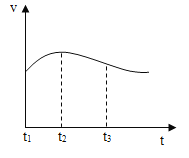
(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因是_______。
研究二:反应后所得溶液的酸碱性探究
(发现问题)
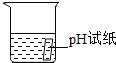
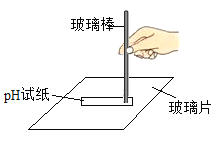
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈_____________性,(选填“酸”“碱”或“中”)。
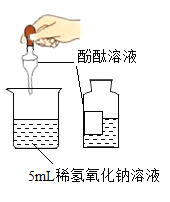
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色,说明乙同学所得溶液呈________性。对此现象,乙同学重复如上实验,得到同样结果。
(提出猜想)
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色;猜想Ⅱ:镁与热水反应使酚酞变红色。
(实验与思考)
为验证猜想,甲、乙两同学均需测定___________溶液的酸碱性,实验表明该溶液显弱酸性。乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与热水反应的化学反应方程式_____________。
(结论)
镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
镁与稀盐酸反应,镁过量时所得溶液显碱性。
【答案】去除表面的氧化镁 放热 反应属于放热反应,温度升高加快反应速率 酸 碱 氯化镁 ![]()
【解析】
研究一:(1)镁与氧气易发生反应生成氧化镁,包裹在镁表面,不利于盐酸与镁直接接触发生反应,所以需要去除表面的氧化镁;
故答案为:去除表面的氧化镁。
(2)外壁发烫,说明有热量产生,因此反应属于放热反应;
故答案为:放热。
(3)反应为放热反应,温度升高,加快反应速率,所以t1~t2时间内反应速率逐渐加快;
故答案为:反应属于放热反应,温度升高加快反应速率。
研究二:(1)酸性溶液的pH小于7,碱性溶液的pH大于7,中性溶液的pH等于7,所以此时溶液呈酸性;
故答案为:酸。
(2)加入酚酞显红色,说明溶液显碱性;
故答案为:碱。
[实验与思考]甲和乙都猜想氯化镁溶液具有酸碱性,并且镁与盐酸反应,一定生成氯化镁,所以需要先测试氯化镁溶液的酸碱性;加入酚酞变红,说明有碱的存在,因此生成的碱为氢氧化镁,此时没有看到沉淀,说明氢氧化镁能溶于热水,气体可以点燃,以及根据质量守恒定律,说明气体为氢气,所以反应物为镁与热水,生成物为氢氧化镁和氢气,据此书写化学方程式为![]() ;
;
故答案为:氯化镁;![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学生在一定温度下,向质量均为 100g 的四份水中分别加入一定质量的 KNO3固体,搅拌至充分溶解(如有不能溶解的 KNO3,则过滤除去),得到溶液,该学生在实验 中记录的数据如下:
实验序号 | 实验 1 | 实验 2 | 实验 3 | 实验 4 |
水的质量(g) | 100 | 100 | 100 | 100 |
加入 KNO3 的质量(g) | 80 | 100 | 120 | 140 |
溶液质量(g) | 180 | 200 | 210 | 210 |
(1)根据上述数据分析,实验______________和_____________得到饱和溶液。
(2)KNO3 饱和溶液的质量分数是_____________。(取整数)
(3)该温度下 KNO3 的溶解度是_____________g ( g/100g 水)o