题目内容
【题目】下列图示的实验操作错误的是
A.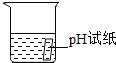 测定溶液 pHB.
测定溶液 pHB.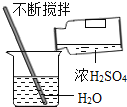 稀释浓硫酸
稀释浓硫酸
C.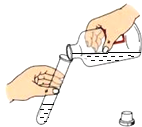 倾倒液体D.
倾倒液体D.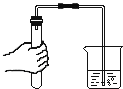 检查气密性
检查气密性
【答案】A
【解析】
A、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误;
B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,图中所示操作正确;
C、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨,图中所示操作正确;
D、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气,图中所示操作正确。
故选A。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】兴趣小组的同学对金属的某些性质进行相关探究。
(实验回顾)
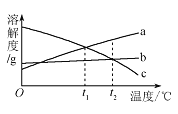
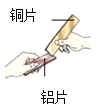
(1)如图所示,将两块金属片进行相互刻划。该实验的目的是_____。
(2)用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜着(资料:铝的熔点660℃,氧化铝的熔点2054℃。)。请解释原因_____。
(实验探究)铝与氯化铜溶液的反应

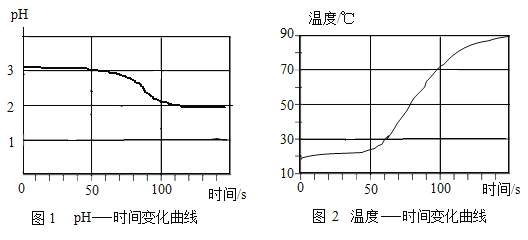
将打磨过的铝片放在15%氯化铜溶液中,观察到铝片表面逸出大量无色气体,且附着红色物质,过一段时间还有白色沉淀产生。利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示)。
(实验反思)
(1)写出生成红色物质的化学方程式为_____。
(2)结合图1分析,铝和氯化铜溶液反应生成的无色气体是_____(填名称)。
(提出问题)白色沉淀的化学成分是什么?
(查阅资料)
①氢氧化铝、氯化亚铜(CuCl)均是难溶于水的白色固体。
②CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl—。
③Cu(NH3)2+在空气中易被氧化变为蓝色;Cl—可与硝酸银溶液反应,产生白色沉淀。
(实验方案)将上述实验中产生的沉淀过滤出来,并洗涤干净后,加入浓氨水,沉淀部分溶解得到无色溶液,将无色溶液分为两份,进行实验。
操作步骤 | 实验现象 | 实验结论 |
用试管取其中一份溶液,滴加适量AgNO3溶液 | _____ | 该溶液中含有Cl— |
将另一份溶液置于空气中一段时间 | _____ | 该溶液中含有Cu(NH3)2+ |
(实验结论)通过实验可以确定,该白色固体是CuCl。
(反思与评价)
(1)小组同学将Cu粉与15%CuCl2溶液混合,没有观察到白色沉淀。在老师的启发下,结合图2“温度-时间变化曲线”,对实验进行改进,确证了Cu与CuCl2溶液反应生成CuCl。请你写出改进后的实验方案是_____。
(2)经过讨论CuCl是Cu与CuCl2化合反应生成。
(思维拓展)
(1)金属锌、铜和稀硫酸构成化学电池(如图)。观察到铜片表面有气泡(H2),小电珠发光、烧杯中溶液始终无色。下列关于实验的分析不正确的是_____(填序号)。
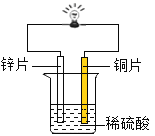
A 铜与稀硫酸发生了置换反应
B 铜的金属活动性变得比锌强
C 烧杯中溶液的pH会逐渐增大
D 该装置将电能转化为化学能
(2)某工厂化验室用20%NaOH溶液来中和上图实验前烧杯中的H2SO4,共消耗NaOH溶液20g,反应后的溶液呈中性,则上图烧杯中原来所含H2SO4的质量为_____(写出计算过程)。