题目内容
【题目】下列实验操作错误的是( )
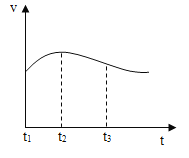
A.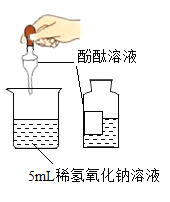 测定氢氧化钠溶液酸碱性B.
测定氢氧化钠溶液酸碱性B.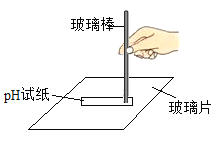 测定溶液pH
测定溶液pH
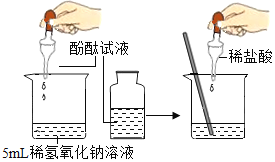
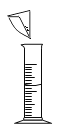
C.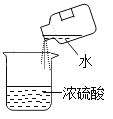 稀释浓硫酸D.
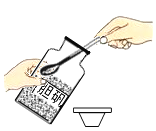
稀释浓硫酸D.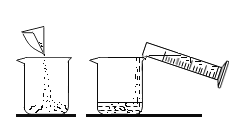 配制氯化钠溶液
配制氯化钠溶液
【答案】C
【解析】
A、无色酚酞遇碱性溶液变红,向氢氧化钠溶液中滴加酚酞可以测定氢氧化钠溶液酸碱性,A正确。
B、测定溶液pH值,将pH试纸放到玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,将变色后的pH试纸和标准比色卡进行对比,B正确。
C、在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌。切不可将水倒进浓硫酸中,如果水倒进浓硫酸中,由于水的密度小,浮在硫酸的上面,硫酸溶解时放出的热量不易散失,使水暴沸,带着酸向四处飞溅,有可能发生意外,故C错。
D、氯化钠溶液的配制,计算、称量、溶解,先称量氯化钠固体放入烧杯中,再量取水溶解,故D正确。
故选:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】分类和类比是学习化学常用的方法。
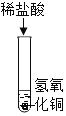
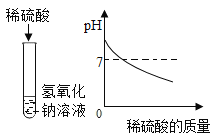
(1)下列实验都能探究酸与碱之间能否发生反应。请从“定性研究”或“定量研究”的角度,将下列实验中的A与_____________ (填字母) 归为一类,理由是________________。
|
|
|
A | B在少量的氢氧化铜固体中加入足量的稀盐酸 | C向氢氧化钠溶液不断滴加稀硫酸,边加边用酸度计测定溶液的pH |
(2)我们学习过铁和稀硫酸的反应:![]() ,高中以后还将学习铁和浓硫酸在加热条件下的反应:
,高中以后还将学习铁和浓硫酸在加热条件下的反应:![]() 。由此可知,反应物相同时,_________和____________不同,生成物不同。
。由此可知,反应物相同时,_________和____________不同,生成物不同。
【题目】分类和类比是学习化学常用方法。
(1)化学是一门以实验为基础的科学,下面是我们在初中化学课本经历的实验:
|
|
|
|
A | B | C | D |
根据化学方程式提供的信息将上述实验平均分两类,选出的一组实验是_____。你的分类依据是_____。
(2)已知H2、CO、C是初中常见的还原剂,请根据它们还原氧化铜的方程式中各元素化合价的变化情况,分析在反应![]() 中作为还原剂的是_____,该反应的氧化剂中发生改变的元素,其化合价的变化情况是_____。
中作为还原剂的是_____,该反应的氧化剂中发生改变的元素,其化合价的变化情况是_____。