题目内容
【题目】乳酸亚铁(C6H10FeO6)是一种很好的食品铁强化剂,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。乳酸亚铁溶于水形成带绿色的透明溶液,几乎不溶于乙醇。
(查阅资料)(1)Fe2+容易被氧气氧化成Fe3+。
(2)碳酸亚铁在空气中灼烧会生成一种铁的氧化物和CO2气体。
I.制备碳酸亚铁(装置如下图所示)
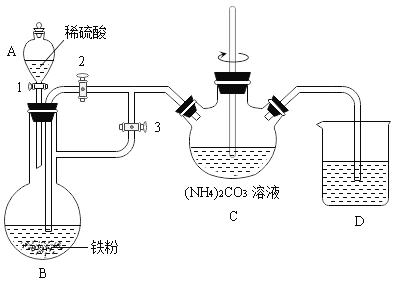
(1)B装置中反应的现象为_________(至少写两条)。C中玻璃棒的作用是_______。
(2)为了成功制得碳酸亚铁,实验开始时打开止水夹1、3关闭止水夹2。待B中反应即将结束时再打开止水夹2关闭止水夹3,目的是__________。反应结束后,将制得的碳酸亚铁浊液过滤、洗涤。
II.探究碳酸亚铁性质
(3)利用如图,称取11.6g纯净的碳酸亚铁固体放入硬质玻璃管中,打开K,通入氧气,加热硬质玻璃管,B瓶中澄清石灰水不再产生沉淀停止加热,继续通入氧气至玻璃管冷却,称得剩余固体质量净减3.6g。通过计算确定剩余固体的成分________(写出计算过程)。
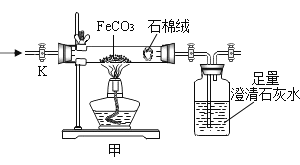
(4)写出A中反应的化学方程式__________。
III.制备乳酸亚铁
将制得的FeCO3加入到足量乳酸溶液中,再加入一定量铁粉(防止Fe2+被氧化),75℃以下搅拌反应。
(5)反应结束后,无需过滤,除去过量铁粉所需的试剂是__________(填字母)。
A 盐酸 B 硫酸铜 C 乳酸 D 氯化亚铁
(6)从乳酸亚铁溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气蒸发浓缩、________、过滤、洗涤、干燥。
(7)已知人体不能很好地吸收利用Fe3+,科学家研究表明服用含乳酸亚铁的补血剂时,同时服用维生素C有利于铁元素的吸收,维生素C在这一过程中的作用是__________。
【答案】铁粉逐渐消失,产生气泡,溶液由无色变成浅绿色(至少写对两点,才得分) 搅拌,加快反应速率 铁和硫酸反应生成氢气,压强增大,使B中的硫酸亚铁溶液进入C中 碳酸亚铁分解生成氧化亚铁,氧化亚铁和氧气反应生成氧化铁设分解的碳酸亚铁质量为x。
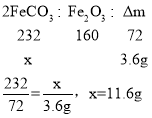
故:碳酸亚铁完全反应,固体只有Fe2O3 4FeCO3+O2 =2Fe2O3+4CO2 C 降温结晶 防止Fe2+氧化成Fe3+
【解析】
(1)铁粉和硫酸反应,生成硫酸亚铁和氢气,固体溶解溶液变为浅绿色,有气体生成,玻璃棒的作用可以搅拌加快反应速度,故填:铁粉逐渐消失,产生气泡,溶液由无色变成浅绿色;搅拌,加快反应速率。
(2)为了成功制得碳酸亚铁,实验开始时打开1、3关闭2 ,让反应产生的氢气把装置中的空气排出去,待B中反应即将结束时再打开2关闭3 ,反应继续产生氢气,使得压强增大,目的是利用氢气将硫酸亚铁溶液压入C中,故填:铁和硫酸反应生成氢气,压强增大,使B中的硫酸亚铁溶液进入C中。
(3)碳酸亚铁分解生成氧化亚铁,氧化亚铁和氧气反应生成氧化铁设分解的碳酸亚铁质量为x。
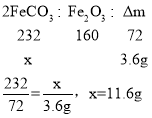
故:碳酸亚铁完全反应,固体只有Fe2O3
(4)碳酸亚铁和氧气反应生成了氧化铁和二氧化碳,化学方程式为4FeCO3+O2 ![]() 2Fe2O3+4CO2,故填:4FeCO3+O2
2Fe2O3+4CO2,故填:4FeCO3+O2 ![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。
(5)反应结束后,无需过滤,除去过量铁粉所需的试剂是乳酸,可以和铁反应,生成乳酸亚铁,不引入新的杂质,故选:C。
(6)从乳酸亚铁溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气蒸发浓缩、降温结晶、过滤、洗涤、干燥,故填:降温结晶。
(7)已知人体不能很好地吸收利用Fe3+,科学家研究表明服用含乳酸亚铁的补血剂时,同时服用维生素C有利于铁元素的吸收,维生素C在这一过程中的作用是防止Fe2+氧化成Fe3+故填:防止Fe2+氧化成Fe3+。

【题目】某学生在一定温度下,向质量均为 100g 的四份水中分别加入一定质量的 KNO3固体,搅拌至充分溶解(如有不能溶解的 KNO3,则过滤除去),得到溶液,该学生在实验 中记录的数据如下:
实验序号 | 实验 1 | 实验 2 | 实验 3 | 实验 4 |
水的质量(g) | 100 | 100 | 100 | 100 |
加入 KNO3 的质量(g) | 80 | 100 | 120 | 140 |
溶液质量(g) | 180 | 200 | 210 | 210 |
(1)根据上述数据分析,实验______________和_____________得到饱和溶液。
(2)KNO3 饱和溶液的质量分数是_____________。(取整数)
(3)该温度下 KNO3 的溶解度是_____________g ( g/100g 水)o