��Ŀ����
����Ŀ��ij��ɫ������BaCl2��NaOH��Na2CO3��Na2SO4�е�һ�ֻ���������ɣ�ij��ȤС��Ϊȷ����ɷ֣�����������ʵ��̽����
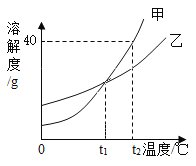
��.����̽��:С��ͬѧ��Ƶ�ʵ����̼���������ͼ��ʾ
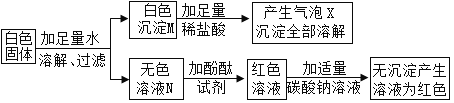
���������ϣ�BaCl2��Һ�����ԣ�BaSO4����������ϡ������ᡣ
������������(1)��ɫ����M�Ļ�ѧʽ��________________����������X�Ļ�ѧ����ʽ��_______________
(2)��ҺN�е�����һ����_____________________��һ��û���Ȼ�����
(3)ԭ��ɫ������һ���е�������____________��һ��û�е�������_________________��
���������ۣ�СӢͬѧ��Ϊ����ɫ��ҺN�μӷ�̪��Һ���죬˵����ҺN�к��м������ʣ��������ɴ��Ƶ���ԭ�����������Ƿ����������ƣ���Ҫ��һ��ȷ���������ҺN��������̽����Ϊ��ͬѧ�ǽ��������µ�̽����
��.����̽����
��������⣩��ɫ��ҺN��������������?
����������裩����1����NaOH������2��û��NaOH
��̽������ۣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ��ɫ��ҺN�������BaCl2��Һ������ | ______ | ֤����ҺN����̼���Ʋ��ѱ����� |
ȡ�������������ϲ���Һ���Թ��У�����________ | _______ | ����1��ȷ |
���𰸡�BaCO3 BaCO3+2HCl=BaCl2 +CO2��+H2O NaCl BaCl2��Na2CO3 Na2SO4 �а�ɫ�������� ��ɫ��̪��Һ ��Һ����ɫ��Ϊ��ɫ
��������
��1����ɫ����M��ϡ����ȫ���ܽ⣬�Ҳ������ݣ���MΪ̼�ᱵ�������������ᱵ����Ϊ���ᱵ���������ᣬM�Ļ�ѧʽΪBaCO3����������X�Ļ�ѧ����ʽ��BaCO3+2HCl=BaCl2 +CO2��+H2O��
��2����ΪMΪ̼�ᱵ�����ɫ������һ�������Ȼ�����̼���ƣ�����ҺN�е�����һ�������ɵ��Ȼ��ƣ�һ��û���Ȼ�������Ϊ��̼��������������
��3�� ��ɫ����M��ϡ����ȫ���ܽ⣬�Ҳ������ݣ���MΪ̼�ᱵ�������������ᱵ����ԭ��ɫ������һ���е�������BaCl2��Na2CO3��һ��û�е�������Na2SO4����Ϊ���ᱵ���������ᡣ
��4��ȡ��ɫ��ҺN�������BaCl2��Һ�����ã�����֤����ҺN����̼���Ʋ��ѱ�������̼�������Ȼ�����Ӧ����̼�ᱵ�������Ȼ��ƣ���۲쵽ʵ���������а�ɫ�������ɡ�
��5������1��ȷ������Һ�к����������ƣ�ȡ�������������ϲ���Һ���Թ��У�������ɫ��̪��Һ����̪��Һ�����Һ��ɺ�ɫ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
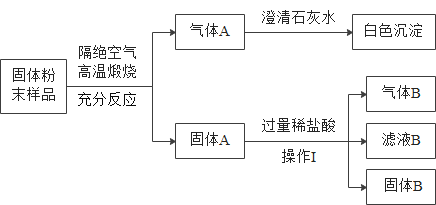
Сѧ��10����Ӧ����ϵ�д�����Ŀ��Ϊ��ȡ����Ķ�����̼���壬����֤������̼����������������Һ���Է�����ѧ��Ӧ���������̽��ʵ��
�����ϣ���̼���ơ�ˮ��������̼���Ի�������̼�����ơ�
��20��ʱ���������ơ�̼���ƺ�̼�����Ƶ��ܽ�����±���ʾ��
���� | NaOH | Na2CO3 | NaHCO3 |
�ܽ��/g | 110 | 21.8 | 9.6 |
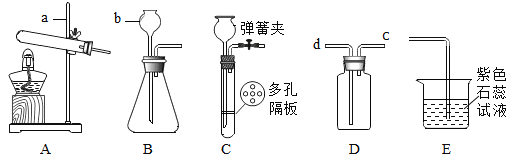
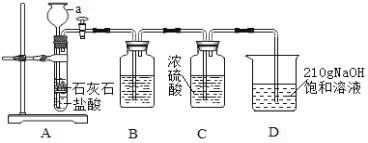
���裺ʵ�������װ��D���¶�ά����20�棬�������Ƶ�װ�ú����ϻش����⣺
������̽����
(1)����a��������_____________��ҪʹA�з�Ӧֹͣ������IJ���������__________________��
(2)װ��B��ʢ�� NaHCO3��Һ������������װ��A�лӷ�����HC���壬B�з�����Ӧ�Ļ�����Ӧ������____________��Ӧ(ѡ��:�������������ֽ��������û����������ֽ���)��
(3)װ��C��������________________________________________��
(4)��ʵ�������װ��D�й۲쵽______________________________��˵��CO2��NaOH��Һ�ܷ�����Ӧ����ͨ��װ��D�е�CO2����ʱ��������Na2CO3���ϳ� NaHCO3���÷�Ӧ�Ļ�ѧ����ʽ��_________________________��