题目内容
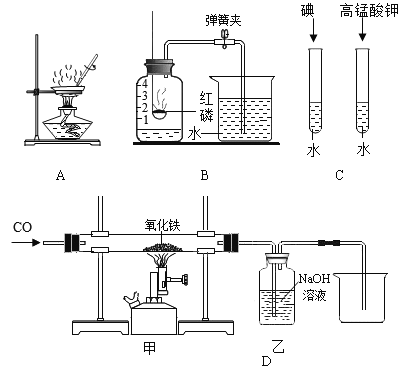
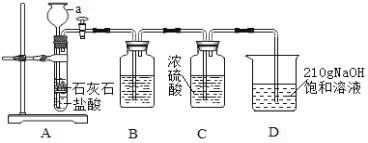
【题目】为制取干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应,设计如下探究实验
(资料)①碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
②20℃时,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示。
物质 | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 110 | 21.8 | 9.6 |
假设:实验过程中装置D的温度维持在20℃,请根据设计的装置和资料回答问题:
(定性探究)
(1)仪器a的名称是_____________,要使A中反应停止,最简便的操作方法是__________________。
(2)装置B中盛有 NaHCO3溶液,作用是吸收装置A中挥发出的HC气体,B中发生反应的基本反应类型是____________反应(选填:“化合”、“分解”、“置换”、“复分解”)。
(3)装置C的作用是________________________________________。
(4)在实验过程中装置D中观察到______________________________,说明CO2和NaOH溶液能发生反应,当通入装置D中的CO2过多时,还会与Na2CO3化合成 NaHCO3,该反应的化学方程式是_________________________。
【答案】长颈漏斗 关闭活塞 复分解 干燥气体 出现沉淀 CO2+Na2CO3+H2O=2NaHCO3
【解析】
(1)仪器a是长颈漏斗,要使A中反应停止,最简便的操作方法是关闭活塞,当关闭活塞,气体不能排出,压强增大,把液体压入长颈漏斗中,固体和液体分离,反应停止。
(2)装置B中盛有 NaHCO3溶液,作用是吸收装置A中挥发出的HC气体,碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,该反应是盐与酸的反应,属于复分解反应。
(3)装置C中是浓硫酸,它具有吸水性,作用是干燥气体。
(4)由表格数据可知,20℃时,氢氧化钠的溶解度为110 g,碳酸钠的溶解度为21.8 g,在装置D中210 g氢氧化钠饱和溶液中通入二氧化碳,可观察到有沉淀产生,说明CO2和NaOH溶液能发生反应,因为100 g 水中最多能溶解21.8 g 碳酸钠。当通入装置D中的CO2过多时,还会与Na2CO3化合成 NaHCO3,该反应的化学方程式是CO2+Na2CO3+H2O=2NaHCO3。

 名校课堂系列答案
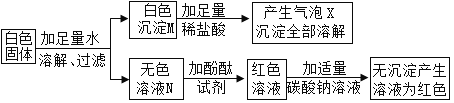
名校课堂系列答案【题目】某白色固体由BaCl2,NaOH、Na2CO3、Na2SO4中的一种或几种物质组成,某兴趣小组为确定其成分,进行了如下实验探究。
Ⅰ.初步探究:小金同学设计的实验过程及现象如下图所示
(查阅资料)BaCl2溶液显中性,BaSO4沉淀不溶于稀硝酸等酸。
(初步分析)(1)白色沉淀M的化学式是________________,产生气体X的化学方程式是_______________
(2)溶液N中的溶质一定有_____________________,一定没有氯化钡。
(3)原白色固体中一定有的物质是____________,一定没有的物质是_________________。
(交流讨论)小英同学认为:无色溶液N滴加酚酞试液后变红,说明溶液N中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠,若要进一步确定,需对溶液N继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究:
(提出问题)无色溶液N中有氢氧化钠吗?
(猜想与假设)猜想1:有NaOH;猜想2:没有NaOH
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
取无色溶液N加入过量BaCl2溶液,振荡后静置 | ______ | 证明溶液N中有碳酸钠并已被除尽 |
取上述步骤所得上层清液于试管中,加入________ | _______ | 猜想1正确 |