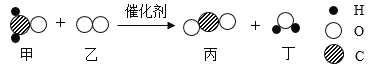
题目内容
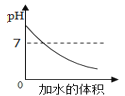
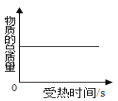
【题目】小组同学利用图四装置研究稀盐酸与氢氧化钠溶液反应的过程,仪器A中溶液慢慢加入烧杯中溶液,用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图五和图六。

①烧杯中发生反应的化学方程式为_____。
②图六中V的数值最接近_____(填“6”、“12”或“16”)。
③有关说法错误的是_______(填序号)。
A 图五中b点所示溶液中通入二氧化碳,无明显现象
B 取图五中d点所示溶液加热蒸干所得固体为混合物
C 图五中c→d所示溶液中NaCl的质量不断增加
D 图六中e→f变化趋势可说明该反应是放热反应
④在图四实验结束后的溶液中加入硫酸铜溶液,观察到________,也可验证稀盐酸与氢氧化钠能发生反应。
【答案】NaOH + HCl =NaCl + H2O 12 B C (错、漏不给分) 无明显现象(或无蓝色沉淀)
【解析】
①烧杯中发生反应为稀盐酸与氢氧化钠反应生成氯化钠和水,化学方程式为NaOH + HCl =NaCl + H2O;
②中和反应放热,图六中V对应的温度最高,说明氢氧化钠和盐酸刚好完全反应,溶液的pH为7,结合图五可知,数值最接近12;
③A、图五中b点所示溶液中pH>7溶液呈碱性,溶液中的溶质是NaCl和NaOH,通入二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠和水,但反应无明显现象,选项正确;
B、取图五中d点盐酸过量,所示溶液溶质是氯化钠和氯化氢,加热蒸干所得固体为只有氯化钠,为纯净物,选项错误;
C、在c点盐酸和氢氧化钠恰好完全反应,c→d所示溶液中,氯化钠的质量不会增加,选项错误;
D、图六中e→f溶液温度不断升高,变化趋势可说明该反应是放热反应,选项正确。
故选BC;
④由图五可知,在图四实验结束后的溶液中溶质为氯化钠和盐酸,加入硫酸铜溶液,观察到无明显现象,也可验证稀盐酸与氢氧化钠能发生反应。

 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】某白色固体由BaCl2,NaOH、Na2CO3、Na2SO4中的一种或几种物质组成,某兴趣小组为确定其成分,进行了如下实验探究。
Ⅰ.初步探究:小金同学设计的实验过程及现象如下图所示
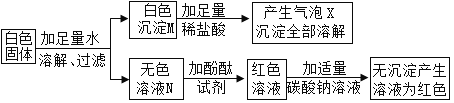
(查阅资料)BaCl2溶液显中性,BaSO4沉淀不溶于稀硝酸等酸。
(初步分析)(1)白色沉淀M的化学式是________________,产生气体X的化学方程式是_______________
(2)溶液N中的溶质一定有_____________________,一定没有氯化钡。
(3)原白色固体中一定有的物质是____________,一定没有的物质是_________________。
(交流讨论)小英同学认为:无色溶液N滴加酚酞试液后变红,说明溶液N中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠,若要进一步确定,需对溶液N继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究:
(提出问题)无色溶液N中有氢氧化钠吗?
(猜想与假设)猜想1:有NaOH;猜想2:没有NaOH
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
取无色溶液N加入过量BaCl2溶液,振荡后静置 | ______ | 证明溶液N中有碳酸钠并已被除尽 |
取上述步骤所得上层清液于试管中,加入________ | _______ | 猜想1正确 |
【题目】某班两组同学利用稀硫酸和氢氧化钠溶液进行了如下实验:
(1)第一小组同学测量9.8%的稀硫酸和10%的氢氧化钠溶液中和反应过程中温度的变化。
①第一步:关于溶液的配制和保存
首先,该小组同学将配制好的10%的氢氧化钠溶液,倒入带_____塞的细口瓶中,备用。其次,该组同学用如表标签所示的浓硫酸配制100g溶质质量分数为9.8%的稀硫酸。请列式计算所需水的体积_____。
硫酸
化学式H2SO4
相对分子质量98
质量分数98%
本试剂为无色透明的粘稠液体
有腐蚀性!
②该小组同学量取了8组均为8mL的氢氧化钠溶液,分别向其中加入一定体积的稀硫酸,测得温度变化如表所示:
实验组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
加入稀硫酸的体积 (V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液温度上升 (△t)/℃ | 4.8 | 8.4 | 11.2 | 11.1 | 13.1 | 11.4 | 10.2 | 9.2 |
其中实验组别为_____(填实验组别的序号)的一组数据明显不合理,判断理由是_____。
(2)第二小组同学计划探究中和反应过程中的pH变化情况。他们取稀释后的氢氧化钠溶液25g,向其中加入溶质质量分数为9.8%的稀硫酸,加入稀硫酸的质量与溶液pH的变化情况如图所示。计算:
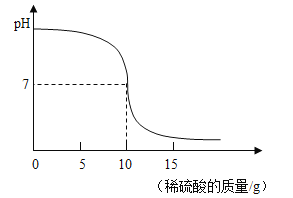
①当两者恰好完全中和时,所得溶液中溶质的质量分数_____。(计算结果精确到0.1%)
②已知:20℃时硫酸钠的溶解度为19.5g。若要将反应后所得溶液恰好转化为20℃时的饱和溶液,最简单的方法是_____。