题目内容
【题目】某兴趣小组同学对长期露置于空气中的化学药品成分变化情况做了以下探究。
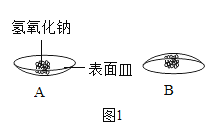
(1)取少量氢氧化钠固体置于表面皿上,几分钟后将表面皿倒置现象如图1B所示,通过细致观察发现氢氧化钠_____。放置几天以后,观察到图IC中的现象,为检验氢氧化钠是否完全变质,小组同学设计了下列实验。
实验操作 | 实验现象 | 结论 |
① _____ | 生成白色沉淀 | 药品 部分变质 |
②待①中反应恰好完全时静置,取上层清液溶液少许于试管中,滴加几滴酚酞溶液 | 溶液由无色变部分变质 成红色 |
(2)①中发生的化学反应方程式是_____。
(3)盐酸与空气成分均不发生化学反应,所以久置盐酸中的物质种类不会发生变化。
同学们对久置稀盐酸溶质质量分数的变化情况开展了探究。
I.提出猜想:猜想一:溶质质量分数不变
想二:溶质质量分数减小
猜想三:溶质质量分数_____。
Ⅱ.实验准备
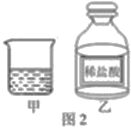
该小组在实验室配制了一定浓度的稀盐酸分装在甲烧杯和乙试剂瓶中,塞好乙瓶的瓶塞(如图2)。置于相同环境中,放置一段时间。
Ⅲ.设计方案,并完成实验,记录如表所示
实验操作 | 实验现象 | 实验结论 | |
方案一 | 取等质量等浓度的NaOH溶液于两个锥形瓶中,均加3滴酚酞 溶液,分别滴加甲、乙中的稀盐酸,记录消耗稀盐酸的质量 | ①溶液时,消耗稀盐酸的质量: 甲<乙 | 猜想三 |
方案二 | 分别取少量甲、乙中稀盐酸于试管中,用玻璃棒蘸取滴在置于表面皿中的用pH试纸上,与标准比色卡对照 | ②pH值:甲_____乙 |
【答案】潮解 取少量白色粉末,加水溶解,然后加入足量氯化钙溶液 Na2CO3+CaCl2=CaCO3↓+2NaCl 变大 <
【解析】
解:(1)氢氧化钠曝露在空气中容易吸收水分,表面潮湿并逐渐溶解,这种现象叫做潮解;检验氢氧化钠是否完全变质就是检验白色固体中是否还含有氢氧化钠,由于碳酸钠溶液显碱性,在设计实验时要先将碳酸钠除去,然后向溶液中加入酚酞试剂,检验溶液中是否还含有氢氧化钠;故填:潮解;①、取少量白色粉末,加水溶解,然后加入足量氯化钙溶液;
(2)碳酸钠与氯化钙反应生成碳酸钙和氯化钠,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;故填:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)久置稀盐酸溶质质量分数可能不变、变小、变大;由于猜想三正确,久置稀盐酸溶质质量分数变大,酸性增强,pH减小;故填:变大;<。