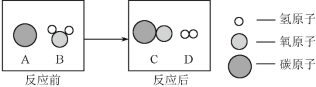
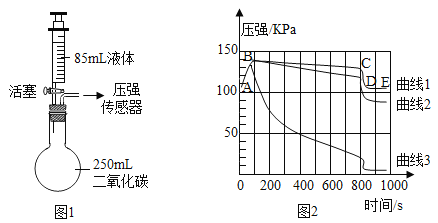
题目内容
【题目】化学与我们人类形影不离,请用所学的化学知识填空。
(1)请写出符合下列要求的物质各一种(用化学式表示):
①人体中含量最多的物质__________; ②食醋中的酸____________________;
③治疗胃酸过多的盐______________; ④用于改良酸性土壤的碱___________。
(2)如图是一个灯泡,请根据图示回答下列问题:
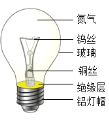
①图中标示的物质属于金属材料的是_____(填名称,1个即可);
②玻璃是一种复杂的混合物,其中一种成分是由硅和氧两种元素组成的化合物,该化合物的化学式为_________;
③小红不小心打破了一个灯泡,他把破烂的灯泡进行拆解后,应将铝制灯帽放入标记为______(填写“可回收垃圾”或“不可回收垃圾”)的垃圾桶内;
④铝具有很好的抗腐蚀性的原因________________________(写化学方程式)。
【答案】![]()
![]()
![]()
![]() 钨丝/铜丝/铝灯帽
钨丝/铜丝/铝灯帽 ![]() 可回收垃圾
可回收垃圾 ![]()
【解析】
(1)①人体中含量最多的物质是水,化学式为![]() 。
。
②食醋中的酸是醋酸,化学式为![]() 。
。
③治疗胃酸过多的盐是碳酸氢钠,化学式为![]() 。
。
④用于改良酸性土壤的碱是氢氧化钙,化学式为![]() 。
。
(2)①图中标示的物质属于金属材料的是钨丝/铜丝/铝灯帽。
②玻璃是一种复杂的混合物,其中一种成分是由硅和氧两种元素组成的化合物,该化合物是二氧化硅,化学式为![]() 。
。
③小红不小心打破了一个灯泡,他把破烂的灯泡进行拆解后,应将铝制灯帽放入标记为可回收垃圾,金属要回收利用。
④铝具有很好的抗腐蚀性的原因是铝和氧气反应生成致密的氧化铝薄膜,化学式为![]() 。
。

【题目】海水中含有大量的氯化钠,工业上常用精制的氯化钠为原料制备纯碱,请你回答下列问题:
(1)从物质的元素组成上分析,需要加入含______元素的物质,但实际生产过程中,通常是先向饱和食盐水中通入氨气,制成饱和氨盐水,原因是______________________________________。
(2)工业上制得的纯碱中常含有少量的氯化钠(不考虑其它杂质),某化学兴趣小组的同学要测定某工厂生产的纯碱样品中碳酸钠的质量分数,设计如下方案:方案一:甲、乙、丙三位同学分別称取一定质量的样品放入烧杯中,溶入足量水后向滤液中加入一定质量的氯化钙溶液,充分反应后过滤,将沉淀洗涤、干燥并称量。相关实验数据记录如下表所示。
称量项目 | 甲 | 乙 | 丙 |
所取样品的质量/g | 12 | 12 | 15 |
加入氯化钙溶液的质量/g | 150 | 100 | 100 |
反应后所得沉淀的质量/g | 10 | 10 | 10 |
①请你分析上述数据,计算该样品中碳酸钠的质量分数。(写出计算步骤,计算结果保留到0.1%)______。
②方案二:丁同学用电子天平分别称取12g相同的碳酸钠样品和100g稀盐酸,充分反应后,测得烧杯内剩余物质的质量为108.6g,则该同学测得的碳酸钠的质量分数_________(填“大于”“小于”“等于”)方案一中测得的碳酸钠的质量分数。原因可能是_________________。(假设装置气密性良好)
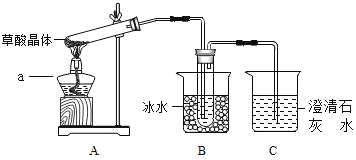
【题目】某兴趣小组同学对长期露置于空气中的化学药品成分变化情况做了以下探究。
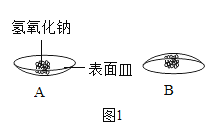
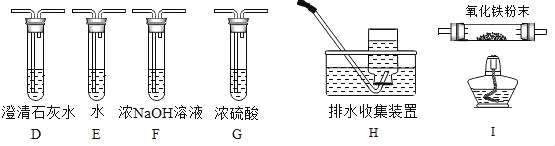
(1)取少量氢氧化钠固体置于表面皿上,几分钟后将表面皿倒置现象如图1B所示,通过细致观察发现氢氧化钠_____。放置几天以后,观察到图IC中的现象,为检验氢氧化钠是否完全变质,小组同学设计了下列实验。
实验操作 | 实验现象 | 结论 |
① _____ | 生成白色沉淀 | 药品 部分变质 |
②待①中反应恰好完全时静置,取上层清液溶液少许于试管中,滴加几滴酚酞溶液 | 溶液由无色变部分变质 成红色 |
(2)①中发生的化学反应方程式是_____。
(3)盐酸与空气成分均不发生化学反应,所以久置盐酸中的物质种类不会发生变化。
同学们对久置稀盐酸溶质质量分数的变化情况开展了探究。
I.提出猜想:猜想一:溶质质量分数不变
想二:溶质质量分数减小
猜想三:溶质质量分数_____。
Ⅱ.实验准备
该小组在实验室配制了一定浓度的稀盐酸分装在甲烧杯和乙试剂瓶中,塞好乙瓶的瓶塞(如图2)。置于相同环境中,放置一段时间。
Ⅲ.设计方案,并完成实验,记录如表所示
实验操作 | 实验现象 | 实验结论 | |
方案一 | 取等质量等浓度的NaOH溶液于两个锥形瓶中,均加3滴酚酞 溶液,分别滴加甲、乙中的稀盐酸,记录消耗稀盐酸的质量 | ①溶液时,消耗稀盐酸的质量: 甲<乙 | 猜想三 |
方案二 | 分别取少量甲、乙中稀盐酸于试管中,用玻璃棒蘸取滴在置于表面皿中的用pH试纸上,与标准比色卡对照 | ②pH值:甲_____乙 |
【题目】分析处理图表中的信息是学习化学的一种重要方法。
(1)如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.20℃时,NaCl的溶解度是_____g。
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为_____(只列计算式,不需要计算结果)。
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是_____。
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是_____。
(2)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
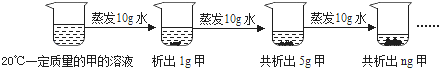
Ⅰ.蒸发前原溶液是_____(填“饱和”或“不饱和”)溶液。n的数值是_____。
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是_____(填字母)。
A 随温度升高而增大 B 随温度升高而减小 C 无法判断