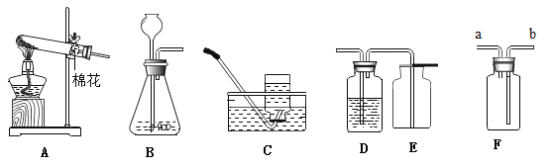
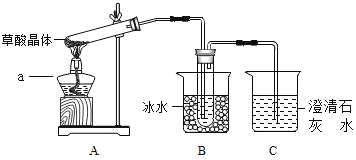
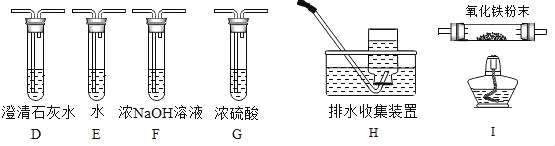
题目内容
【题目】甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
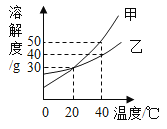
A. 40℃时,等质量的甲、乙形成饱和溶液质量:甲>乙
B. 将等质量的甲、乙两种溶液从40℃降温至20℃时析出的晶体:甲>乙
C. 20℃时,等质量的甲、乙饱和溶液中溶质的质量分数一定相等
D. 40℃时,将30g的乙物质加入到50g水中可形成乙的不饱和溶液
【答案】C
【解析】
根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而甲的溶解度随温度的升高变化比乙大;
A、40℃时,等质量的甲、乙形成饱和溶液质量:甲<乙,甲>乙错误;
B、将等质量的甲、乙两种溶液从40℃降温至20℃时析出的晶体:甲>乙错误;
C、20℃时,等质量的甲、乙饱和溶液中溶质的质量分数一定相等正确;
D、40℃时,将30g的乙物质加入到50g水中可形成乙的不饱和溶液错误。
A、40℃时,等质量的甲、乙形成饱和溶液质量:甲<乙,甲>乙错误;故选项错误;
B、将等质量的甲、乙两种溶液从40℃降温至20℃时析出的晶体:甲>乙错误,因为没有指明是饱和溶液;故选项错误;
C、20℃时,等质量的甲、乙饱和溶液中溶质的质量分数一定相等正确;故选项正确;
D、40℃时,将30g的乙物质加入到50g水中可形成乙的饱和溶液,不饱和溶液错误;故选项错误;
故选:C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】海水中含有大量的氯化钠,工业上常用精制的氯化钠为原料制备纯碱,请你回答下列问题:
(1)从物质的元素组成上分析,需要加入含______元素的物质,但实际生产过程中,通常是先向饱和食盐水中通入氨气,制成饱和氨盐水,原因是______________________________________。
(2)工业上制得的纯碱中常含有少量的氯化钠(不考虑其它杂质),某化学兴趣小组的同学要测定某工厂生产的纯碱样品中碳酸钠的质量分数,设计如下方案:方案一:甲、乙、丙三位同学分別称取一定质量的样品放入烧杯中,溶入足量水后向滤液中加入一定质量的氯化钙溶液,充分反应后过滤,将沉淀洗涤、干燥并称量。相关实验数据记录如下表所示。
称量项目 | 甲 | 乙 | 丙 |
所取样品的质量/g | 12 | 12 | 15 |
加入氯化钙溶液的质量/g | 150 | 100 | 100 |
反应后所得沉淀的质量/g | 10 | 10 | 10 |
①请你分析上述数据,计算该样品中碳酸钠的质量分数。(写出计算步骤,计算结果保留到0.1%)______。
②方案二:丁同学用电子天平分别称取12g相同的碳酸钠样品和100g稀盐酸,充分反应后,测得烧杯内剩余物质的质量为108.6g,则该同学测得的碳酸钠的质量分数_________(填“大于”“小于”“等于”)方案一中测得的碳酸钠的质量分数。原因可能是_________________。(假设装置气密性良好)
【题目】某兴趣小组同学对长期露置于空气中的化学药品成分变化情况做了以下探究。
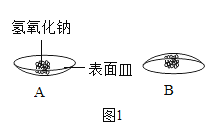
(1)取少量氢氧化钠固体置于表面皿上,几分钟后将表面皿倒置现象如图1B所示,通过细致观察发现氢氧化钠_____。放置几天以后,观察到图IC中的现象,为检验氢氧化钠是否完全变质,小组同学设计了下列实验。
实验操作 | 实验现象 | 结论 |
① _____ | 生成白色沉淀 | 药品 部分变质 |
②待①中反应恰好完全时静置,取上层清液溶液少许于试管中,滴加几滴酚酞溶液 | 溶液由无色变部分变质 成红色 |
(2)①中发生的化学反应方程式是_____。
(3)盐酸与空气成分均不发生化学反应,所以久置盐酸中的物质种类不会发生变化。
同学们对久置稀盐酸溶质质量分数的变化情况开展了探究。
I.提出猜想:猜想一:溶质质量分数不变
想二:溶质质量分数减小
猜想三:溶质质量分数_____。
Ⅱ.实验准备
该小组在实验室配制了一定浓度的稀盐酸分装在甲烧杯和乙试剂瓶中,塞好乙瓶的瓶塞(如图2)。置于相同环境中,放置一段时间。
Ⅲ.设计方案,并完成实验,记录如表所示
实验操作 | 实验现象 | 实验结论 | |
方案一 | 取等质量等浓度的NaOH溶液于两个锥形瓶中,均加3滴酚酞 溶液,分别滴加甲、乙中的稀盐酸,记录消耗稀盐酸的质量 | ①溶液时,消耗稀盐酸的质量: 甲<乙 | 猜想三 |
方案二 | 分别取少量甲、乙中稀盐酸于试管中,用玻璃棒蘸取滴在置于表面皿中的用pH试纸上,与标准比色卡对照 | ②pH值:甲_____乙 |