��Ŀ����
����Ŀ����֪ij������θ��ҩƷ����Ҫ�ɷ�����̼��þƬ����ѧʽΪ�� AlaMgb(OH)16CO3��4H 2O������ҩƷ�е������ɷ����Ȳ��ֽ⡢������ˮ�Ҳ���ϡ���ᷴӦ��ij�о���ѧϰС�����������ʵ��̽����̼��þƬ����ɡ��������ϣ��Ȼ�����һ�ְ�ɫ��״� ��ˮ�Լ�ǿ����¶�ڿ����м��׳��⣻ ��ʯ�����������ƺ������ƵĻ���
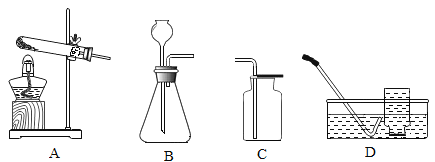
��ʵ��һ��ȡm g ��ҩƬ���гɷ�ĩ����Ӳ�ʲ������У����ȡ�
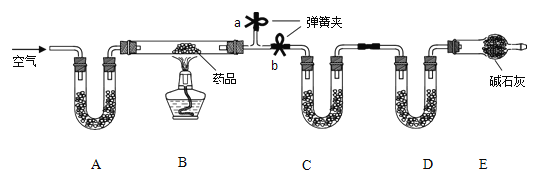
��1����̼��þƬ���ȷֽ�IJ���ΪAl2O3��MgO��CO2 ��ˮ����Ҫ�ⶨ���ɵ� CO2 ��ˮ��������װ�� C��D ��ʢ�ŵ�ҩƷӦѡ��C_________��D_______��������ţ���
��Ũ���� �ڼ�ʯ�� ���Ȼ��� �ܴ���
��2��ʵ�鿪ʼǰ�رյ��ɼ� b���� a����ͨ��һ��ʱ�������װ��A ��ʢ�ŵ��Ǽ�ʯ�ң�����������___��
��3��һ��ʱ��ر���Ӧ�ĵ��ɼУ���ȼ�ƾ��Ƽ��ȣ���ַ�Ӧ��ֹͣ���ȣ�����ͨ��һ��ʱ�������Ŀ����______��
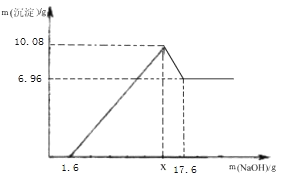
��ʵ�������ȡm g ��ҩƬ������ 100g 19.6%��ϡ���ᣬ��ַ�Ӧ����ȥ������õ����� MgSO4 ��Al2(SO4)3 �����ʵ���Һ������Һ������������ϡ NaOH ��Һ�����������������������Һ�� NaOH �������Ĺ�ϵ��ͼ��
��֪��Al2(SO4)3+6NaOH=2Al(OH)3��+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O�� NaAlO2 ������ˮ��
��1��д�� MgSO4 ��NaOH �ķ�Ӧ����ʽ______��
��2��ͼ�е�������Һ��NaOH ������Ϊ 1.6g ʱ��û�г�����˵����Һ�к���______����������Һ������ NaOH �������� x ʱ�����ɵij�����______��x=_____g��
��3��ҽ��������ø�ҩƬʱһ��Ҫ��������̷�����������ѧ��֪ʶ�������������������______��
��4����ȷ����̼��þ�Ļ�ѧʽΪ______��
����˼�����������ش��ѧ���֣�Դ�Զ��������쳣����Ĵ����ɣ������о������п�ѧ�ɹ���ͨ�����쳣�����о��ó����ǣ�����ţ�______��
A ��°�DZ���о��Ƽ�������������Ƽ
B �����������о�ǰ�˺��ӵ��쳣������������
C ���������ֲⶨ�˶���Ԫ�����ԭ����������ֵ
D�����������Ũ���ὦ�������ϴӶ����������ָʾ��
���𰸡��� �� ��ȥ�����еĶ�����̼��ˮ����ֹ��ʵ�����IJⶨ��ɸ��� ʹ���ɵ�ˮ�Ͷ�����̼��ȫ��C��Dװ������ MgSO4+2NaOH�TMg��OH��2��+Na2SO4 H2SO4 Mg(OH)2��Al(OH)3 16g ����Ӵ������ʹ���տ��ٳ�� Al2Mg6(OH)16CO3��4H2O�� BD
��������
ʵ��һ��
��1��װ��C��D ��ʢ�ŵ�ҩƷ�ֱ����Ȼ��ơ���ʯ�ң��ֱ���������ˮ������������̼����ѡ�ۣ��ڡ�
��2��ʵ�鿪ʼǰ�رյ��ɼ�b������һ�����ɼУ���ͨ��һ��ʱ�������װ��A��ʢ�ŵ��Ǽ�ʯ�ң��������������տ����е�ˮ�����Ͷ�����̼��
��3����ַ�Ӧ��ֹͣ���ȣ�����ͨ��һ��ʱ�������Ŀ����ʹ��Ӧ���ɵ�ˮ������������̼ȫ����C��Dװ�����ա�
ʵ�����
��1��MgSO4 ��NaOH��Ӧ����������þ�����������ơ���Ӧ����ʽΪMgSO4+2NaOH�TMg��OH��2��+Na2SO4��
��2��ͼ�е�������Һ��NaOH������Ϊ1.60gʱ��û�г�����˵����Һ�к������ᣬ���������Ⱥ����ᷴӦ��
��������Һ��NaOH��������xʱ������������࣬���ɵij�����������þ������������
����Al��OH��3�������ǣ�10.08g-6.96g=3.12g��
����������
![]()
x=16g��
��3��ҽ��������ø�ҩƬʱһ��Ҫ��������̷���������������������ڳ�����ա�
��6����Ԫ������Ϊ��3.12g��![]() =1.08g��
=1.08g��
������þ������6.96g��þԪ������Ϊ��6.96g��![]() =2.88g��
=2.88g��
��̼��þ����ԭ�Ӻ�þԭ�Ӹ�����Ϊ��![]() ��
��![]() =1��3��
=1��3��
��̼��þ�У�̼������ϼ���-2�����������ϼ���-1��ˮ��Ԫ�صĻ��ϼ۴�����Ϊ�㣬���ݻ�������Ԫ�ػ��ϼ۴�����Ϊ���֪����Ԫ�غ�þԪ�صĻ��ϼ۴�������+18��������̼��þ����ԭ�Ӻ�þԭ�Ӹ�����Ϊ1��3�������̼��þ�Ļ�ѧʽΪAl2Mg6��OH��16CO34H2O��
��˼������
�����о��ɹ���֪����������ͨ�����쳣�����о��ó��ġ������Dz����������Ũ������������ϴӶ����������ָʾ���������������о�ǰ�˺��ӵ��쳣����������������ѡBD��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
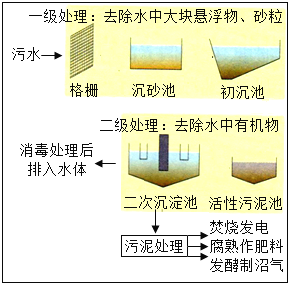
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij��ȤС��ͬѧ�Գ���¶���ڿ����еĻ�ѧҩƷ�ɷֱ仯�����������̽����
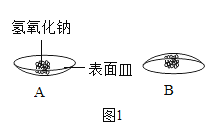
��1��ȡ�����������ƹ������ڱ������ϣ������Ӻ�������������ͼ1B��ʾ��ͨ��ϸ�¹۲췢����������_____�����ü����Ժ۲쵽ͼIC�е�����Ϊ�������������Ƿ���ȫ���ʣ�С��ͬѧ���������ʵ�顣
ʵ����� | ʵ������ | ���� |
�� _____ | ���ɰ�ɫ���� | ҩƷ ���ֱ��� |
�������з�Ӧǡ����ȫʱ���ã�ȡ�ϲ���Һ��Һ�������Թ��У��μӼ��η�̪��Һ | ��Һ����ɫ�䲿�ֱ��� �ɺ�ɫ |
��2�����з����Ļ�ѧ��Ӧ����ʽ��_____��
��3������������ɷ־���������ѧ��Ӧ�����Ծ��������е���������ᷢ���仯��
ͬѧ�ǶԾ���ϡ�����������������ı仯�����չ��̽����
I��������룺����һ������������������
�������������������С
��������������������_____��
��ʵ����
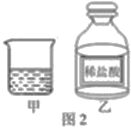
��С����ʵ����������һ��Ũ�ȵ�ϡ�����װ�ڼ��ձ������Լ�ƿ�У�������ƿ��ƿ������ͼ2����������ͬ�����У�����һ��ʱ�䡣
����Ʒ����������ʵ�飬��¼�����ʾ
ʵ����� | ʵ������ | ʵ����� | |
����һ | ȡ��������Ũ�ȵ�NaOH��Һ��������ƿ�У�����3�η�̪ ��Һ���ֱ�μӼס����е�ϡ���ᣬ��¼����ϡ��������� | ����Һʱ������ϡ����������� �ף��� | ������ |
������ | �ֱ�ȡ�����ס�����ϡ�������Թ��У��ò�����պȡ�������ڱ������е���pH��ֽ�ϣ������ɫ������ | ��pHֵ����_____�� |
����Ŀ����������ͼ���е���Ϣ��ѧϰ��ѧ��һ����Ҫ������
��1�������KNO3��NaCl�ڲ�ͬ�¶��µ��ܽ�ȣ���λ��g/100gˮ��
�¶ȣ��棩 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
��.20��ʱ��NaCl���ܽ����_____g��
��.30��ʱ��KNO3��Һ�����Ũ�ȣ���������������Ϊ_____��ֻ�м���ʽ������Ҫ����������
��KNO3 �к������Ȼ���ʱ���ᴿ����ص�һ�㷽����_____��
�������ݱ������ݿ�֪��KNO3��NaCl��ijһ�¶�ʱ������ͬ���ܽ��X����X��ȡֵ��Χ��_____��
��2����ͼ�Ƕ�20��һ�������ļ���Һ���к��������ᾧ��ʵ����̣���ش�
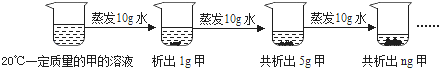
������ǰԭ��Һ��_____������͡������͡�����Һ��n����ֵ��_____��
����������ʵ�飬����Ϊ���ܽ�����¶ȱ仯��������_____������ĸ����
A ���¶����߶����� B ���¶����߶���С C ���ж�
����Ŀ����ͼ��ʾ����Һ��X���뵽����ƿ�������Y���ã��۲쵽������������Һ��X����Y����ϣ�����������ǣ�������
�� | �� | �� | �� | �� | |
X | ϡ���� | ˮ | ˮ | ˫��ˮ | ˮ |
Y | ���� | �������� | �Ȼ��� | �������� | ����� |
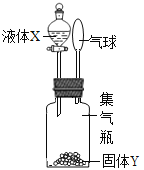
A. �٢ڢ� B. �٢ۢ� C. �٢ڢ� D. �ڢۢ�