题目内容
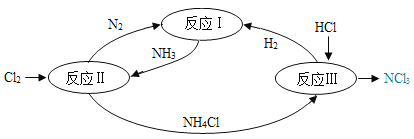
【题目】同学们在教材中看到了下面的图示,想到了用天然气烧水,于是整合了火力发电和烧水的流程如下图,试回答下列问题。

(1)烧煤发电(火力发电)时的能量转化是_____;
(2)烧水的水壶最好使用的材料是(____)
A 焊锡
B 钛合金
C 不锈钢
D 生铁
(3)含锡(Sn)的矿石主要是锡石,主要成分为二氧化锡,锡的冶炼可以用焦炭高温还原锡石,写出用焦炭炼锡的化学方程式_____,反应过程中锡元素的化合价变化为_____。
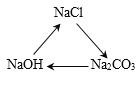
【答案】化学能转化电能 C 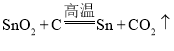 由正4价变为0价
由正4价变为0价
【解析】
(1)煤炭燃烧是化学变化,烧煤发电是将化学能转化为电能,故填:化学能转化电能;
(2)A、焊锡熔点较低,不适合做烧水水壶,不符合题意;
B、钛合金与人体有很好的相容性,适用于制造人体骨骼,价格较高,不适合做烧水水壶,不符合题意;
C、不锈钢耐腐蚀性好,不容易生锈,适合做水壶,符合题意;
D、生铁容易生锈,不适合做水壶,不符合题意;
故选:C。
(3)二氧化锡和焦炭在高温下可以生成锡和二氧化碳,化学方程式为
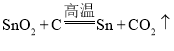 锡元素化合价反应前设为x,根据化合价代数和为零,x+(-2)×2=0,x=+4,反应后变为单质,化合价为零价,故填:
锡元素化合价反应前设为x,根据化合价代数和为零,x+(-2)×2=0,x=+4,反应后变为单质,化合价为零价,故填: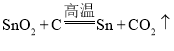 ;由正4价变为0价;
;由正4价变为0价;

【题目】碳酸镁水合物是制备镁产品的中间体。
Ⅰ.(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图1:
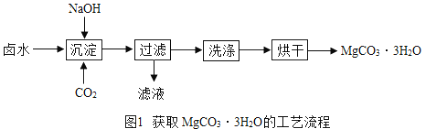
(1)沉淀过程得到了MgCO33H2O晶体和氯化钠的混合物,写出沉淀过程发生的化学反应方程式:________________________________________________。
(2)过滤需要用到的玻璃仪器有烧杯、玻璃棒和______,证明MgCO33H2O沉淀已洗涤干净的方法是,取最后一次洗涤液,_____________________________,说明已洗净。
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如下表所示。
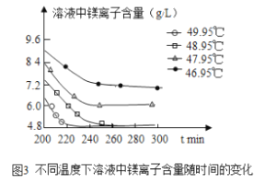
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为________,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
Ⅱ.(测定MgCO33H2O的纯度)
(查阅资料)
a.碱石灰是CaO与NaOH的固体混合物。
b.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
c.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24 MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
(实验步骤)
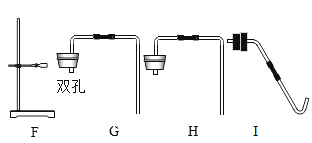
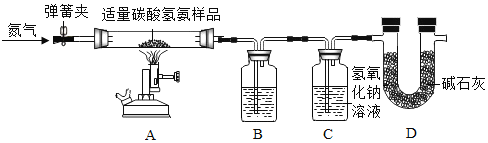
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
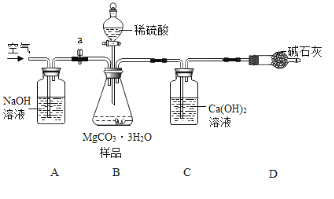

依据实验过程回答下列问题:
(1)实验结束后需持续缓缓通入空气,其作用为______________________________。
(2)C装置中反应生成CaCO3的化学方程式为_______________________;D中碱石灰的作用为_______________________________。
(3)下列各项措施中,能提高测定准确度的是_________(填标号)。
a在加入硫酸之前,应排净装置内的CO2气体
b为了缩短实验时间,快速滴加硫酸
c在B~C之间增添盛有浓硫酸的洗气装置
d在C装置左侧导管末端增添多孔球泡
e将C装置中澄清石灰水换成Ba(OH)2溶液
(4)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)。______
(5)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(O3)44H2O,则样品中MgCO33H2O的纯度___(填“偏大”“不变”或“偏小”)。