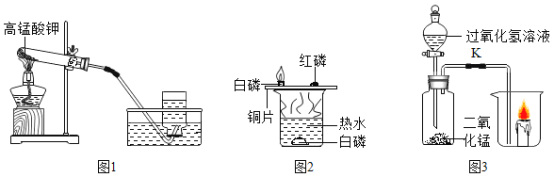
题目内容
【题目】如图是甲、乙、丙三种物质的溶解度曲线。下列叙述错误的是( )
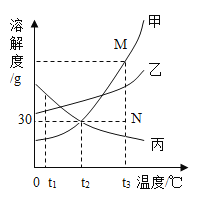
A.t2℃时,等质量的甲、丙饱和溶液中所含溶质的质量相等
B.t2℃时,15g丙溶解于50g水中能形成65g溶液
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
【答案】C
【解析】
A、t2℃时,甲、丙两种物质的溶解度相等,则两种饱和溶液的溶质质量分数相等。根据题意可知,两种饱和溶液的质量相等,则两种溶液的溶质的质量也相等。A正确;
B、t2℃时,丙的溶解度为30g,则表示在该温度下,100g的水中,最多能溶解丙30g。则 50g水中最多能溶解15g的丙,形成溶液的质量为:15g+50g=65g。B正确;
C、t3℃时,三种物质的溶解度和饱和溶液的溶质质量分数顺序为:甲>乙>丙。现分别将三种物质的饱和溶液从t3℃降温至t2℃时,由于甲、乙两种物质的溶解度随温度的升高而增大,则降温时,溶液依然为饱和溶液且有溶质析出,且降温后,乙的溶解度大于甲的溶解度,则该温度下,乙的饱和溶液的溶质质量分数大于甲的饱和溶液的溶质质量分数。而丙物质的溶解度随温度的升高而减小,则降温后,溶质的质量分数不变且小于甲。则降温后,所得溶液溶质质量分数的大小关系为:乙>甲>丙。C错误;
D、若要将组成在N点的甲溶液转变为M点的甲溶液,N点是该温度下的甲的不饱和溶液,M点是该温度下的甲的饱和溶液。可以选择增加溶质、恒温蒸发溶剂进行转化。D正确。
故选C。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】某化学兴趣小组使用如图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入20.0g合金样品。开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 | |
读数(g) | 28.5 | 169.7 | 189.6 | 189.5 | 189.4 | 189.3 | 189.3 |
(1)合金中锌元素的质量分数为多少?
(2)完全反应后.烧杯中盐的质量为多少克? (计算结果精确至0.1g)
【题目】回答下列实验中的有关问题。
|
|
|
A | B | C |
(1)A中正极产生气体的检验方法是_____。
(2)B中通过比较①②塑料瓶变瘪的不同,可得出的结论是_____。
(3)C中可观察到的现象是_____,反应的化学方程式是_____。