题目内容
【题目】小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如右图所示。从图中所获信息不正确的是


A. 反应过程中有热量放出B. 50s时,溶液中溶质为AlCl3
C. 0~50s,发生Al2O3+6HCl===2AlCl3+3H2O反应D. 100—140s,压强减小是因为温度降低
【答案】B
【解析】
A、由图可知,反应过程中温度升高,说明反应过程中有热量放出,正确;
B、由图可知,50s时,反应仍在进行,说明溶液中稀盐酸有剩余,故溶液中溶质为AlCl3和HCl,错误;
C、由图可知,0~50s时,压强无明显变化,说明铝表面有氧化铝,稀盐酸先与氧化铝反应,未与铝反应,正确;
D、100—140s时,反应结束,温度降低,气压减小,正确。故选B。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0g |
剩余固体的质量 | 1.5g | m | 0.5g | 0.3g | 0.3g |
计算:
(1)m=______g。
(2)石灰石中碳酸钙的质量分数为______。
(3)2.0g石灰石样品与足量稀盐酸反应,产生二氧化碳的质量是多少?_____(写出解题过程)
【题目】碳酸钠、碳酸氢钠是生活中两种常见的重要的盐。
(1)碳酸钠(俗称纯碱、苏打)与碳酸氢钠(俗称_____),均为________色固体,水溶液均呈_______性,向它们的水溶液中分别滴入无色酚酞试液,酚酞试液均变红色。
(2)碳酸钠、碳酸氢钠均可与稀盐酸反应,其中碳酸钠与稀盐酸反应的化学方程式为_____。但是,碳酸钠、碳酸氢钠与稀盐酸反应产生二氧化碳的速率是否相同?校兴趣小组同学针对于此,展开探究:
(方案设计)
①甲设计的实验如图1所示,实验时,同时全部推出足量稀盐酸后,观察到图2所示现象。于是他得出______和稀盐酸反应产生二氧化碳较快的结论。
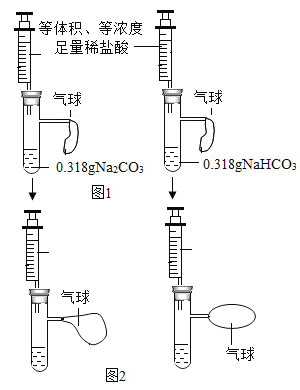
②乙同学通过计算可知:0.318 g碳酸氢钠约产生0.167 g二氧化碳,而0.318 g碳酸钠产生二氧化碳的质量为______g,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸作用,碳酸氢钠产生二氧化碳的质量更多,显然甲同学的设计不妥,应取含碳元素质量相同的碳酸钠和碳酸氢钠进行实验。若碳酸钠的质量仍为0.318g,应称取碳酸氢钠的质量为_______g。
③小组同学在老师指导下设计了图3所示实验。连通管除消除稀盐酸滴入占有体积引起的误差,还有______的作用。
分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液(各滴2滴酚酞溶液)以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,广口瓶内压强随时间变化如图4所示,溶液颜色变化记录如表1。
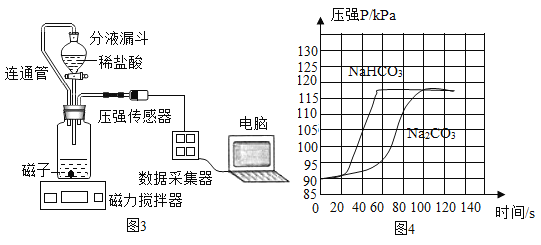
表1:
滴入酚酞溶液 | 滴入稀盐酸,溶液颜色变化 | |
碳酸钠溶液 | 红色 | 红色→浅红色→无色 |
碳酸氢钠溶液 | 浅红色 | 淺红色→无色 |
(实验结论)分析图4所示的实验数据可得到:相同条件下,碳酸氢钠与稀盐酸反应产生二氧化碳速率更快,你判断的理由是_______。
(实验反思)小组同学分析表1实验现象和图4数据,得出碳酸钠能与稀盐酸反应产生二氧化碳,反应是分步进行的。第一步发生的化学反应方程式是:_______,第二步发生的反应是:NaHCO3+HCl=NaCl+H2O+CO2↑。
【题目】野外探险,可以利用供氧剂过氧化钠(Na2O2)与CO2反应制取O2, 化学反应方程式为:![]() 。
。
(1) Na2O2中O元素的化合价是_______________。
(2)某兴趣小组的同学查阅资料,了解到二氧化硫(SO2)性质与CO2类似,可以与水反应生成亚硫酸(H2SO3),也可以与生石灰反应生成亚硫酸钙(CaSO3),还可以与氢氧化钠反应生成亚硫酸钠(Na2SO3)。
(提出问题)二氧化硫(SO2)与过氧化钠(Na2O2)反应,是否与CO2的完全一致?
(查阅资料)
I.少量二氧化硫(SO2)通入澄清石灰水中,也可以看到溶液变为混浊。写出溶液变为浑浊所发生的化学反应方程式_______________。
Ⅱ.亚硫酸钠(Na2SO3)固体和盐酸反 应会放出二氧化硫(SO2);
Ⅲ.亚硫酸钡(BaSO3)固体不溶于水,但可溶于盐酸放出二氧化硫(SO2)。
(提出猜想)二氧化硫(SO2)与过氧化钠(Na2O2)反应,若过氧化钠(Na2O2)完全反应,生成的固体产物;
猜想一:可能只有Na2SO3;
猜想二:可能只有Na2SO4;
猜想三:可能___________________
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
①取少量固体产物于烧杯,加入蒸馏水,搅拌溶解。 | 固体完全溶解。 | 钠盐均可溶于水。 |
②取少量①中所得溶液于试管,加入盐酸溶液。 | 有气体放出。 | 说明猜想_________(填“一”或“二”或“三”)是错误的。 |
③另取少量①中所得溶液于试管,加入适量BaCl2溶液, 过滤。 | 有沉淀生成。 | 生成的沉淀可能是__________(填化学式)。 |
④取③中得沉淀,加入足量的_________溶液。 | 有气体放出,沉淀部分溶解。 | 说明猜想三成立。 |
(实验结论)
猜想三成立。请写出④中放出气体所发生的化学反应方程式_______________。
(交流讨论)实验结束后,同学们一起讨论, 二氧化硫(SO2)与过氧化钠(Na2O2)反应生成硫酸钠是什么原理?他们带着这个问题去请教老师:老师告诉他们,二氧化硫(SO2)与过氧化钠(Na2O2)反应生成硫酸钠,是氧化还原反应。在氧化还原反应中,有元素化合价升高,必定有元素化合价降低。硫酸钠的生成,有两种可能:
a.生成的亚硫酸钠(Na2SO3)被O2氧化所得,发生的化学反应方程式为_______________。
b.过氧化钠(Na2O2)直接将二氧化硫(SO2)氧化所得。