题目内容
【题目】化学与我们的生活息息相关。在日常生活中我们经常使用肥皂来清洗衣物,肥皂的主要成分是硬脂酸钠![]() 。下列有关硬脂酸钠的说法中正确的是
。下列有关硬脂酸钠的说法中正确的是![]()
A.硬脂酸钠是由五种元素组成的
B.硬脂酸钠是由18个碳原子、35个氢原子、2个氧原子和1个钠原子构成的
C.硬脂酸钠中碳元素和氢元素的质量比为18:35
D.肥皂水能使紫色的石蕊溶液变蓝
【答案】D
【解析】
A、硬脂酸钠是由碳、氢、氧、钠四种元素组成的,故选项说法错误;
B、硬脂酸钠是由硬脂酸钠分子构成的,1个硬脂酸钠分子是由18个碳原子、35个氢原子、2个氧原子和1个钠原子构成的,故选项说法错误;
C、硬脂酸钠中碳元素和氢元素的质量比为![]() ,故选项说法错误;
,故选项说法错误;
D、肥皂水显碱性,能使紫色的石蕊溶液变蓝,故选项说法正确。
故选D。

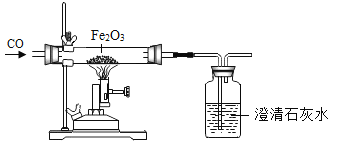
【题目】学习了酸的性质后,同学们知道了硫酸可以和金属发生反应,为了探究浓硫酸是不是能和非金属反应,某兴趣小组的同学进行了如下探究。将冷的浓硫酸加入到装有碳粉的圆底烧瓶中,无明显现象,加热该混合物,有大量气泡产生,现对导出的气体成分进行验证。
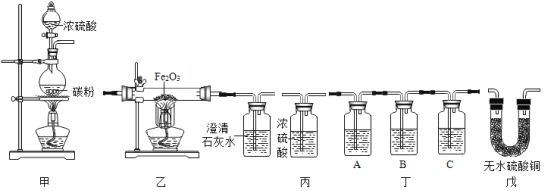
[查阅资料]
①碳与浓硫酸在加热时,除了生成水之外,还生成二氧化硫和碳的一种氧化物;
②水能使无水硫酸铜变蓝;
③二氧化硫和二氧化碳都能使澄清石灰水变浑浊,其中,二氧化硫还能使紫红色的酸性高锰酸钾溶液褪色。
二氧化硫和澄清石灰水反应的化学方程式为_____。
[实验验证]某化学兴趣小组在老师指导下设计了如图实验装置进行验证。
温馨提示:丁装置的A、B、C中均装有紫红色的酸性高锰酸钾溶液
①为了验证反应后的生成物,装置的正确连接顺序为:甲_____→_____→丙→_____(填序号)
②请完成表中的相关内容:
实验现象 | 实验结论 |
乙中观察到的现象_____ | 证明碳与浓硫酸加热反应生成碳的氧化物是二氧化碳而不是一氧化碳 |
丁装置A中溶液褪色,丁装置C中溶液不褪色 | 证明气体中有_____,装置C的作用_____ |
戊中白色固体变蓝 | 证明气体中有水蒸气 |
[获得结论]碳与浓硫酸加热反应的化学方程式_____。
[知识拓展]化学反应的进行与反应物的溶质质量分数、反应条件都有一定关系。酸不仅仅能与某些金属反应,还能与某些非金属单质在一定条件下反应。
【题目】野外探险,可以利用供氧剂过氧化钠(Na2O2)与CO2反应制取O2, 化学反应方程式为:![]() 。
。
(1) Na2O2中O元素的化合价是_______________。
(2)某兴趣小组的同学查阅资料,了解到二氧化硫(SO2)性质与CO2类似,可以与水反应生成亚硫酸(H2SO3),也可以与生石灰反应生成亚硫酸钙(CaSO3),还可以与氢氧化钠反应生成亚硫酸钠(Na2SO3)。
(提出问题)二氧化硫(SO2)与过氧化钠(Na2O2)反应,是否与CO2的完全一致?
(查阅资料)
I.少量二氧化硫(SO2)通入澄清石灰水中,也可以看到溶液变为混浊。写出溶液变为浑浊所发生的化学反应方程式_______________。
Ⅱ.亚硫酸钠(Na2SO3)固体和盐酸反 应会放出二氧化硫(SO2);
Ⅲ.亚硫酸钡(BaSO3)固体不溶于水,但可溶于盐酸放出二氧化硫(SO2)。
(提出猜想)二氧化硫(SO2)与过氧化钠(Na2O2)反应,若过氧化钠(Na2O2)完全反应,生成的固体产物;
猜想一:可能只有Na2SO3;
猜想二:可能只有Na2SO4;
猜想三:可能___________________
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
①取少量固体产物于烧杯,加入蒸馏水,搅拌溶解。 | 固体完全溶解。 | 钠盐均可溶于水。 |
②取少量①中所得溶液于试管,加入盐酸溶液。 | 有气体放出。 | 说明猜想_________(填“一”或“二”或“三”)是错误的。 |
③另取少量①中所得溶液于试管,加入适量BaCl2溶液, 过滤。 | 有沉淀生成。 | 生成的沉淀可能是__________(填化学式)。 |
④取③中得沉淀,加入足量的_________溶液。 | 有气体放出,沉淀部分溶解。 | 说明猜想三成立。 |
(实验结论)
猜想三成立。请写出④中放出气体所发生的化学反应方程式_______________。
(交流讨论)实验结束后,同学们一起讨论, 二氧化硫(SO2)与过氧化钠(Na2O2)反应生成硫酸钠是什么原理?他们带着这个问题去请教老师:老师告诉他们,二氧化硫(SO2)与过氧化钠(Na2O2)反应生成硫酸钠,是氧化还原反应。在氧化还原反应中,有元素化合价升高,必定有元素化合价降低。硫酸钠的生成,有两种可能:
a.生成的亚硫酸钠(Na2SO3)被O2氧化所得,发生的化学反应方程式为_______________。
b.过氧化钠(Na2O2)直接将二氧化硫(SO2)氧化所得。