题目内容
【题目】某化学兴趣小组使用如图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入20.0g合金样品。开始计时,并将电子天平的读数记录在下表中,请回答下列问题:

空烧杯 | 加入硫酸后 | 加入合金后5分钟 | 加入合金后12分钟 | 加入合金后21分钟 | 加入合金后40分钟 | 加入合金后3小时 | |
读数(g) | 28.5 | 169.7 | 189.6 | 189.5 | 189.4 | 189.3 | 189.3 |
(1)合金中锌元素的质量分数为多少?
(2)完全反应后.烧杯中盐的质量为多少克? (计算结果精确至0.1g)
【答案】65% ;32.2g。
【解析】
解:由质量守恒定律可知,产生氢气的质量=169.7g+20.0g-189.3g=0.4g;
设:合金中Zn的质量为x,生成的ZnSO4质量为y。
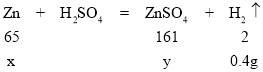
![]() x=13.0g
x=13.0g
![]() y= 32.2g
y= 32.2g
合金中锌的质量分数为![]()
答:(1)合金中锌元素的质量分数为65% ;
(2)完全反应后.烧杯中盐的质量为32.2g。

 名校课堂系列答案
名校课堂系列答案【题目】认识物质的组成和结构,进而能推知物质的性质和用途。
(1)原子结构决定元索性质。
2016年6月8日,国际纯粹与应用化学联合会正式发布113号等四种新元素的英文名称和元素符号。2017年5月9日,我国发布了这四种元素的中文名称。其中113号的元素符号为Nh,中文名称为“鉨”。如图甲、乙分别为鉨原子和铝原子结构示意图。请回答下列问题:
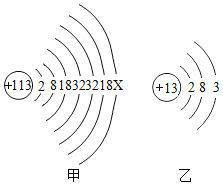
①在化学反应中,鉨原子形成离子的符号为________________。
②根据原子结构,理论上鉨的金属活动性比铝强,你认为可能的原因是________________。
(2)物质组成和结构决定其性质.性质决定其用途。
胃酸过多须服用抗酸药。下表为两种抗酸药的有效成分及其构成微粒:
抗胃酸药 | 复方氢氧化镁片剂 | 铝碳酸镁片 |
有效成分 | Mg( OH)2 | AlMg( OH)3CO3 |
构成微粒 | Mg2+、 OH- | Al3+、Mg2+、 OH-、 CO32- |
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异。
①Mg( OH)2起抗酸作用的微粒是_______________(填微粒符号,下同);
②铝碳酸镁与盐酸反应的化学方程式为:![]() 。铝碳酸镁起抗酸作用的两种微粒是__________________________________。
。铝碳酸镁起抗酸作用的两种微粒是__________________________________。