题目内容
【题目】课堂上,老师和同学们探究了二氧化碳的性质。请回答问题。
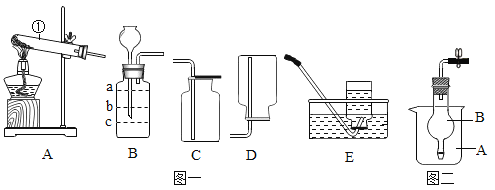
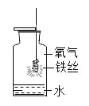
(学习情景)打开汽水瓶盖时,有气泡冒出。同学们将气体通入澄清石灰水中,石灰水变浑浊(如图),发生反应的化学方程式是_______________,实验后,老师要求同学们将试管中的浑浊物再次变得澄清,你认为可采用的方法是____________________。
(提出问题一)汽水中为什么会产生二氧化碳气体呢?
(作出猜想)汽水中溶有二氧化碳,二氧化碳能溶于水。
(进行实验)向一个收集满二氧化碳气体的质地较软的塑料瓶中加入![]() 体积的水、立即拧紧瓶盖,振荡,观察到的现象是_________________,得出二氧化碳能溶于水的洁论。
体积的水、立即拧紧瓶盖,振荡,观察到的现象是_________________,得出二氧化碳能溶于水的洁论。
(提出问题二)二氧化溶于水的过程中是否与水发生了化学反应?
(作出猜想)二氧化碳能与水发生化学反应,生成其它物质。
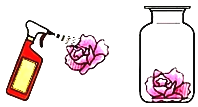
(实验方案)取三朵用紫色石蕊溶液染成紫色的干燥纸花,完成下列实验。
实验操作 | 实验现象及化学方程式 | 实验结论 |
步骤一:将第一朵纸花喷上稀醋酸 | 现象:紫色纸花变红 | 结论:二氧化碳能与水发生化学反应。化学方程式______________。 |
步骤二:将第二朵纸花直接放在盛滿二化碳的集气瓶中。 | 现象:紫色纸花没有变红 | |
步骤三:将第三朵纸花喷 上水后,再放入盛满二氧化碳的集气瓶中 | 现象: _________ | |
步骤四:将步骤三集气瓶 中的纸花取出,用吹风机烘干 | 现象: _________ | 结论: ________ |
(实验总结)汽水为混合物,至少含有以下三种物质:______。(用化学式表示)
【答案】CO2+Ca(OH)2=CaCO3↓+H2O 加入适量的稀盐酸 塑料瓶变瘪 紫色纸花变红 CO2+H2O=H2CO3 红色纸花又变成紫色 在加热的条件下碳酸分解 H2O、CO2、H2CO3
【解析】
根据二氧化碳能够和氢氧化钙反应、和水反应、能够溶于水等性质进行分析。
(1)[学习情景]二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水;碳酸钙能与稀盐酸反应生成可溶于水的氯化钙,因此将试管中的浑浊物变得澄清可加入适量的稀盐酸;
故填:CO2+Ca(OH)2=CaCO3↓+H2O;加入适量的稀盐酸;
(2)[进行实验]二氧化碳能溶于水,向一个收集满二氧化碳气体的质地较软的塑料瓶中加入![]() 体积的水、立即拧紧瓶盖,振荡,瓶中的压强小于外界压强,会观察到塑料瓶会变瘪;
体积的水、立即拧紧瓶盖,振荡,瓶中的压强小于外界压强,会观察到塑料瓶会变瘪;
故填:塑料瓶变瘪;
(3)[实验方案]步骤三:将第三朵纸花喷上水后,再放入盛满二氧化碳的集气瓶中,二氧化碳与水反应生成了碳酸,碳酸能使紫色石蕊变红色;
故填:紫色纸花变红;CO2+H2O=H2CO3;
步骤四:将步骤三集气瓶中的纸花取出,用吹风机烘干,观察到红色纸花又变成紫色,这是因为在加热的条件下碳酸分解生成了二氧化碳和水;
故填:红色纸花又变成紫色;在加热的条件下碳酸分解;
(4)[实验总结]汽水为混合物,至少含有水、二氧化碳和碳酸三种物质。
故填:H2O、CO2、H2CO3。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
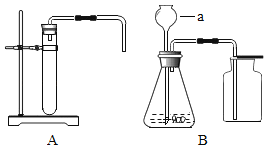
课堂练加测系列答案【题目】硫酸铜溶液能对过氧化氢的分解起催化作用.某小组拟在相同浓度硫酸铜溶液的催化下,探究硫酸铜对不同浓度过氧化氢溶液分解速率的影响.
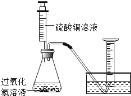
(1)分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的硫酸铜溶液,如图观察到产生气泡的速率不同,就可以粗略判断,得出实验结果.写出有关反应的化学方程式_____ ;
(2)为进一步判断上述实验结论的准确性,运用图,小刚同学进行了如下实验方案设计.
[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
[方案二]在不同过氧化氢浓度下,测定 ____________.
方案二的实验测量结果:
实验序号 物理量 | 过氧化氢溶液的浓度和体积 | 6%硫酸铜溶液的 体积(mL) | 反应的时间 (min) | 生成氧气的 体积(mL) |
1 | 8%10mL | x | 5 | V1 |
2 | 16%10mL | 3 | 5 | V2 |
表中x= _____.
实验结论:通过测量,若V1<V2,说明其它条件相同时, _________.
[继续探究]除了上述探究的影响反应速率的因素外,还有哪些因素可能会影响过氧化氢分解的反应速率?_______________(答一条即可)
【题目】下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实验 | A | B | C | D |
装置 |
|
|
|
|
解释 | 集气瓶中的水:吸 收放出的热量 | 量筒中的水:通过水 的体积变化得出 O2 的体积 | 集气瓶中的水:冷 却溅落熔融物,防 止集气瓶炸裂 | 集气瓶中的水:水 先将集气瓶内的空 气排净 |
A. A B. B C. C D. D
【题目】实验室用块状大理石和5%的稀盐酸反应制取![]() ,观察不到气泡产生时,发现固体还有剩余,化学兴趣小组的同学对此进行探究(杂质不溶于水且不与酸反应)。
,观察不到气泡产生时,发现固体还有剩余,化学兴趣小组的同学对此进行探究(杂质不溶于水且不与酸反应)。
(提出问题)不再产生气泡的原因是什么?
(猜想假设)猜想一:盐酸已经完全反应
猜想二:剩余固体中无碳酸钙
猜想三:生成物或杂质附着在大理石表面,阻碍反应继续进行
(实验探究一)反应后溶液中是否有盐酸。
实验步骤 | 现象 | 结论 |
取上述反应后的清液,测溶液pH | 测得溶液 | 说明溶液显_____性,由此得出猜想一不成立的结论。 |
(质疑)有同学认为此结论不够严谨,还应考虑生成物对溶液酸碱性强弱的影响。
(补充实验)
①取干净的烧杯,另配制_____溶液,测得溶液![]() 。
。
②取洁净的试管,加入适量水和紫色石蕊溶液,持续通入![]() ,发现溶液变为_____色。
,发现溶液变为_____色。
③另取洁净的试管,加入适量水,持续通入![]() 至饱和,测得溶液
至饱和,测得溶液![]() 。
。
以上三个补充实验中,能对质疑作出合理解释的是_____(填实验编号),由此可知,探究一种生成物不会使溶液的_____,猜想一不成立,反应后的溶液中有盐酸。
(实验探究二)剩余固体中是否有碳酸钙。
实验步骤 | 现象 | 结论 |
先振荡反应容器,使剩余固体和液体充分接触 | 仍无气泡产生 | 结论:假设_____不成立。 |
再向容器中滴加少量5%的稀盐酸 | 又有气泡产生,到不再产生气泡时,仍有固体剩余 |
综合探究实验一与探究实验二,可得出影响反应能否进行的因素之一是_____。