题目内容
【题目】宏宏发现氢氧化钠溶液忘记盖瓶盖。对于该溶液是否变质,宏宏等同学进行了探究。请你一起完成下列实验报告。
(1) [提出问题1]该溶液是否变质?
[实验探究1]
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有_________产生 | 说明该溶液已变质。变质的原因是_______(请用化学方程式表示)。 |
(2) [提出问题2]该溶液变质程度怎样?
[提出猜想]
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有___________。
[查阅资料]氯化钡溶液呈中性。
[实验探究2]
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有________生成 | 猜想__________成立 |
静置,取上层清液于另一支试管中,加入2- 3滴酚酞溶液 | 上层清液变红 |
(3) [提出问题3]怎样提纯该样品得到纯净的氢氧化钠固体。
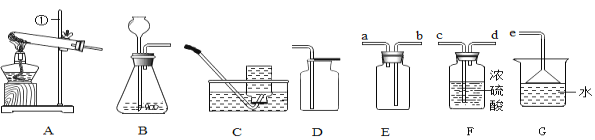
[实验探究3]为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
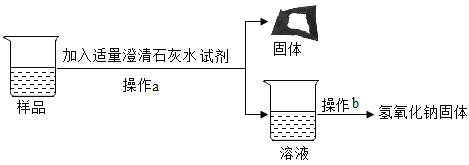
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为_____________.
②根据实验流程可知,最终所得氢氧化钠固体质量___________变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)[反思交流]在[实验探究2]中加入过量的氯化钡溶液的目的是_____________.
(5) [拓展提升]宏宏在完成实验室制取CO2后,对回收的盐酸和CaCl2混合溶液(不考虑其它杂质)进行以下实验:取200g该溶液于烧杯中,向其中滴加溶质质量分数为10. 6%的Na2CO3溶液,滴入Na2CO3溶液与生成沉淀的质量关系如图所示。
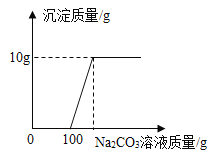
①回收液中HCl的质量分数是多少?___ (写出计算过程)
②当Na2CO3溶液与CaCl2溶液恰好完全反应时,溶液中溶质的质量是多少g?___(写出计算过程)
【答案】气泡 ![]() NaOH、Na2CO3 白色沉淀 二 引流 大于 将碳酸钠完全除去 3.64% 23.4g
NaOH、Na2CO3 白色沉淀 二 引流 大于 将碳酸钠完全除去 3.64% 23.4g
【解析】
(1){提出问题}变质后得到氢氧化钠中含有碳酸钠,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,观察到的现象是产生气泡,故填气泡;
氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水而变质,故反应的化学方程式写为:2NaOH+CO2=Na2CO3+H2O。
(2){提出猜想}如果氢氧化钠部分变质,即一部分氢氧化钠与二氧化碳反应生成碳酸钠和水,则固体中含有剩余的氢氧化钠和生成的碳酸钠,故填NaOH、Na2CO3。
{实验探究2}变质后的氢氧化钠样品中含有碳酸钠,碳酸钠与氯化钡在溶液中反应生成碳酸钡沉淀和氯化钠,观察到的现象是产生白色沉淀,故填白色沉淀;
过量氯化钡溶液能够与全部的碳酸钠反应而将碳酸钠除去,再加入2- 3滴酚酞溶液后,溶液变红,说明溶液中还存在氢氧化钠,即溶液中含有碳酸钠与氢氧化钠,所以猜想二正确,故填二。
(3){实验探究3}①操作a将难溶性固体与液体进行了分离,则操作a是过滤,过滤时玻璃棒的作用是引流,故填引流;
②由图可知,加入的澄清石灰水中的氢氧化钙能与样品中的碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量,故填大于。
(4)氯化钡能与碳酸钠反应生成碳酸钡沉淀和氯化钠,在[实验探究2]中加入过量的氯化钡溶液的目的是完全除去样品中的碳酸钠,避免碳酸钠对验证氢氧化钠的存在产生干扰,故填将碳酸钠完全除去。
(5)解:①由图中数据可知与HCl反应的碳酸钠溶液的质量=100g×10.6%=10.6g
设回收液中HCl的质量为x、生成氯化钠的质量为y
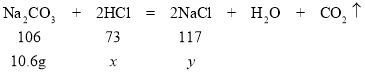
106:73=10.6g:x x=7.3g
106:117=10.6g:y y=11.7g
回收液中HCl的质量分数=![]() ×100%=3.65%
×100%=3.65%
设碳酸钠与氯化钙反应生成的氯化钠的质量为z
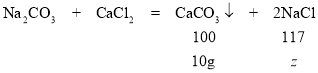
100:117=10g:z
z=11.7g
当Na2CO3溶液与CaCl2溶液恰好完全反应时,溶液中溶质的质量=11.7g+11.7g=23.4g
答: 当Na2CO3溶液与CaCl2溶液恰好完全反应时,溶液中溶质的质量是23.4g。

 优百分课时互动系列答案
优百分课时互动系列答案