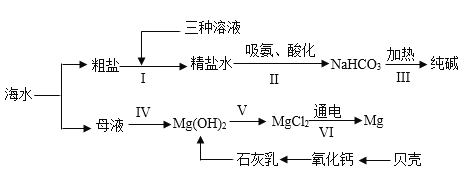
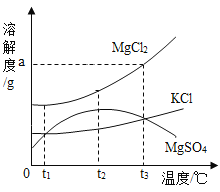
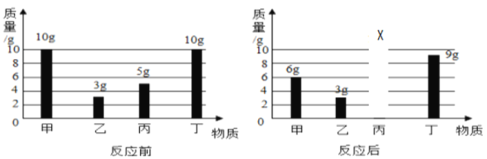
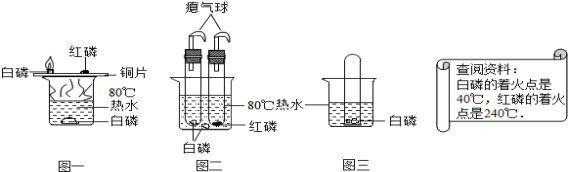
题目内容
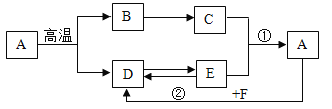
【题目】图中A~I是初中化学常见的物质,且分别由H、N、O、Na、S、Cl、Ca、Cu中的两种或三种元素组成。A、B、C物质类别相同,A、G、H、I由两种元素组成且H、I为氧化物,汽车用铅酸蓄电池中含有C,农业上可用D与F等配制波尔多液。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。
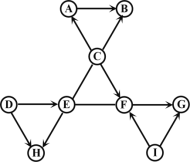
(1)写出化学式:
C__________,G__________,H__________。
(2)写出化学方程式:
A→B_________,D→E________。
【答案】H2SO4 CuCl2 H2O HCl +AgNO3 =AgCl↓+HNO3 Ca(OH)2+Na2CO3 =2NaOH+CaCO3 ↓
【解析】
汽车用铅酸蓄电池中含有C,所以C为硫酸,A、B、C物质类别相同,所以A、B也是酸,且A由两种元素组成,它们由H、N、O、Na、S、Cl、Ca、Cu中的两种或三种元素组成,硫酸与氯化钡反应可以生成盐酸和氯化钡沉淀,盐酸与硝酸银反应可以生成氯化银和硝酸,所以A、B分别是盐酸和硝酸;农业上可用D与F等配制波尔多液,C硫酸可以生成F,所以F为硫酸铜,D为氢氧化钙;D氢氧化钙可以转化为E,E能分别与C硫酸和F硫酸铜发生反应,氢氧化钙与碳酸钠反应生成氢氧化钠,氢氧化钠和硫酸发生酸碱中和,氢氧化钠与硫酸铜反应可以生成氢氧化铜蓝色沉淀,所以E为氢氧化钠;F硫酸铜可以生成G,G由两种元素组成,所以G只能含铜离子,不能含硫酸根,硫酸铜与氯化钡反应可以生成氯化铜,所以G是氯化铜, H、I由两种元素组成,且H、I为氧化物,氧化铜分别与硫酸和盐酸反应可以生成硫酸铜和氯化铜,所以I为氧化铜;D氢氧化钙和E氢氧化钠都可以分别与酸发生反应生成盐和水,所以H为水。综上分析,A、B、C、D、E、F、G、H、I分别是盐酸、硝酸、硫酸、氢氧化钙、氢氧化钠、硫酸铜、氯化铜、水和氧化铜。
(1)由以上分析可得C为硫酸,G为氯化铜,H为水,所以它们的化学式分别为H2SO4、CuCl2、H2O。故填:H2SO4、CuCl2、H2O。
(2)由以上分析可得A、B分别为盐酸和硝酸,所以A→B的反应方程式为HCl +AgNO3 =AgCl↓+HNO3;由以上分析可得D、E分别为氢氧化钙和氢氧化钠,所以D→E的化学方程式为Ca(OH)2+Na2CO3 =2NaOH+CaCO3 ↓。故填:HCl +AgNO3 =AgCl↓+HNO3;Ca(OH)2+Na2CO3 =2NaOH+CaCO3 ↓。

 名校课堂系列答案
名校课堂系列答案【题目】宏宏发现氢氧化钠溶液忘记盖瓶盖。对于该溶液是否变质,宏宏等同学进行了探究。请你一起完成下列实验报告。
(1) [提出问题1]该溶液是否变质?
[实验探究1]
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有_________产生 | 说明该溶液已变质。变质的原因是_______(请用化学方程式表示)。 |
(2) [提出问题2]该溶液变质程度怎样?
[提出猜想]
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有___________。
[查阅资料]氯化钡溶液呈中性。
[实验探究2]
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有________生成 | 猜想__________成立 |
静置,取上层清液于另一支试管中,加入2- 3滴酚酞溶液 | 上层清液变红 |
(3) [提出问题3]怎样提纯该样品得到纯净的氢氧化钠固体。
[实验探究3]为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
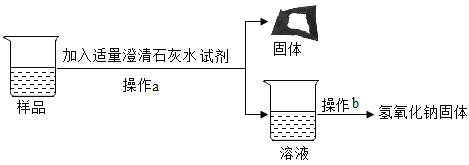
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为_____________.
②根据实验流程可知,最终所得氢氧化钠固体质量___________变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)[反思交流]在[实验探究2]中加入过量的氯化钡溶液的目的是_____________.
(5) [拓展提升]宏宏在完成实验室制取CO2后,对回收的盐酸和CaCl2混合溶液(不考虑其它杂质)进行以下实验:取200g该溶液于烧杯中,向其中滴加溶质质量分数为10. 6%的Na2CO3溶液,滴入Na2CO3溶液与生成沉淀的质量关系如图所示。
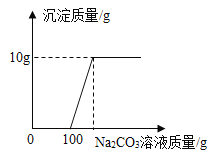
①回收液中HCl的质量分数是多少?___ (写出计算过程)
②当Na2CO3溶液与CaCl2溶液恰好完全反应时,溶液中溶质的质量是多少g?___(写出计算过程)