题目内容
【题目】(1)用化学用语填空
①铝元素_____
②氦气_____
③2个二氧化氮分子_____
④镁离子_____
⑤硝酸根离子_____
⑥标出KClO3中氯元素的化合价_____
(2)写出下列数字意义:
①2CH4中“4”的含义_____
②2NH4+中“2”的含义_____
【答案】Al He 2NO2 Mg2+ NO3- ![]() 一个甲烷分子中含有4个氢原子 两个铵根离子
一个甲烷分子中含有4个氢原子 两个铵根离子
【解析】
(1)①铝元素的元素符号为:Al;
②氦气的符号直接用元素符号表示:He;
③由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则2个二氧化氮分子可表示为:2NO2;
④由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,镁离子可表示为:Mg2+;
⑤离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故硝酸根离子可表示为:NO3-;
⑥氯酸钾中钾元素显+1价,氧元素显-2价,氯元素显+5价;由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故氯酸钾中氯元素的化合价为+5价可表示为:![]() ;
;
(2)①标在化学式中元素右下角的数字表示一个分子在所含原子的数目,2CH4中的“4”表示1个甲烷分子中含有4个氢原子;
②标在离子符号前面的数字表示离子的个数,故2NH4-中的2表示铵根离子的个数为2个。

【题目】宏宏发现氢氧化钠溶液忘记盖瓶盖。对于该溶液是否变质,宏宏等同学进行了探究。请你一起完成下列实验报告。
(1) [提出问题1]该溶液是否变质?
[实验探究1]
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有_________产生 | 说明该溶液已变质。变质的原因是_______(请用化学方程式表示)。 |
(2) [提出问题2]该溶液变质程度怎样?
[提出猜想]
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有___________。
[查阅资料]氯化钡溶液呈中性。
[实验探究2]
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有________生成 | 猜想__________成立 |
静置,取上层清液于另一支试管中,加入2- 3滴酚酞溶液 | 上层清液变红 |
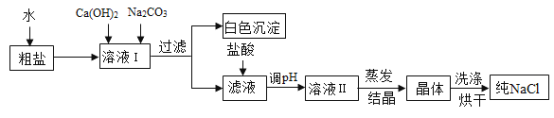
(3) [提出问题3]怎样提纯该样品得到纯净的氢氧化钠固体。
[实验探究3]为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
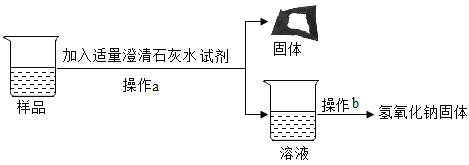
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为_____________.
②根据实验流程可知,最终所得氢氧化钠固体质量___________变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)[反思交流]在[实验探究2]中加入过量的氯化钡溶液的目的是_____________.
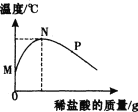
(5) [拓展提升]宏宏在完成实验室制取CO2后,对回收的盐酸和CaCl2混合溶液(不考虑其它杂质)进行以下实验:取200g该溶液于烧杯中,向其中滴加溶质质量分数为10. 6%的Na2CO3溶液,滴入Na2CO3溶液与生成沉淀的质量关系如图所示。
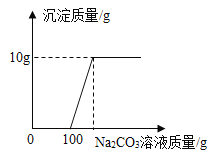
①回收液中HCl的质量分数是多少?___ (写出计算过程)
②当Na2CO3溶液与CaCl2溶液恰好完全反应时,溶液中溶质的质量是多少g?___(写出计算过程)