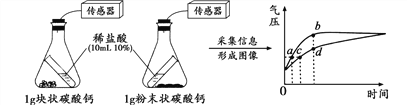
题目内容
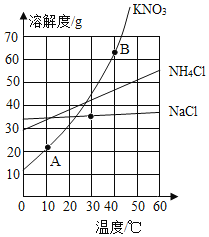
【题目】氯化钠、碳酸钠不同温度下的溶解度如下表所示,请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 |
氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | |
(1)20℃时,30g碳酸钠和30g氯化钠的固体混合物加入到100g水中,充分搅拌后_____(填“是”或“否”)有固体剩余。
(2)生活在盐湖附近的人们“夏天晒盐(氯化钠)”、“冬天捞碱(碳酸钠)”,其冬天捞碱依据的原理是___________(填“蒸发结晶”或“降温结晶”)。
(3)将300g碳酸钠溶液和150g石灰水溶液混合后,恰好完全反应,过滤,得到白色沉淀50g,则所得的滤液中溶质的质量分数多少_____________?。
【答案】 是 降温结晶 ![]() .
.
【解析】(1)20℃时,碳酸钠的溶解度为21.5g,氯化钠的溶解度为36.0g,故碳酸钠不能完全溶解,故有固体剩余;
(2)碳酸钠的溶解度随温度的升高而升高,故冬天捞碱依据是降温结晶;
(3)设生成生成氢氧化钠的质量为x
Na2CO3+Ca(OH)2 == CaCO3 ↓+ 2NaOH
100 80
50g x
![]() =
=![]() x=40g
x=40g
反应后溶液的质量为300g+150g-50g=400g
反应后溶液中溶质的质量分数为![]() =10%
=10%
答:所得的滤液中溶质的质量分数10%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目