题目内容
【题目】下图是稀盐酸和氢氧化钠反应发生过程中各项的变化,请分析:
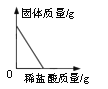
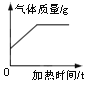
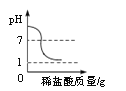
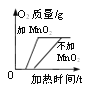
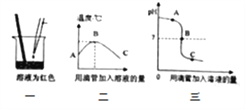
①图一用滴管滴入一定量的溶液后,烧杯中的溶液恰好由红色变成无色,滴管中的试剂是_______,此时是图二中的_______(填“A”、“B”或“C”)点,继续滴加该试剂,得到完成的图二、图三。根据图二、图三的变化分析,判定此反应发生的依据分别是_______、________;
②图三C点溶液中含有的溶质是________;
③在没有指示剂的情况下,下列试剂不能帮助确定上述反应是否发生的是_________。
a.铁粉 b.AgNO3溶液 c.Na2CO3溶液
【答案】 稀盐酸; B; 溶液温度升高; 溶液pH逐渐变小 NaCl、HCl b
【解析】①酚酞遇碱性溶液变红,遇中性或酸性溶液不变色,用滴管滴入一定量的溶液后,烧杯中的溶液恰好由红色变成无色,所以滴管中的试剂是稀盐酸。酸碱反应放出热量,稀盐酸与氢氧化钠恰好反应后再滴入稀盐酸,温度降低,所以恰好反应时对应的点是B。氢氧化钠溶液显碱性,pH>7,稀盐酸与氢氧化钠恰好反应时,溶液的pH=7,继续滴入稀盐酸,溶液的酸性增强,pH<7。所以根据图二、图三的变化分析,判定此反应发生的依据分别是溶液温度升高、溶液pH逐渐变小。②C点溶液的pH<7,显酸性,说明有稀盐酸剩余,此时溶液中的溶质有生成的NaCl以及剩余的HCl。③a.铁粉能与酸反应生成气体而冒气泡,正确;b.无论反应是否发生,都有Cl-存在,能与AgNO3溶液中的Ag+结合产生白色沉淀,错误;c.Na2CO3溶液能与酸反应生成气体而冒气泡,正确。故选c。

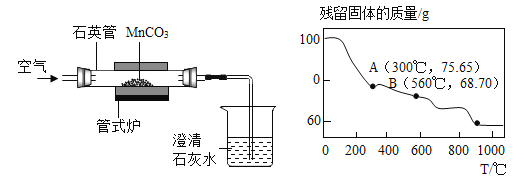
【题目】氯化钠、碳酸钠不同温度下的溶解度如下表所示,请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 |
氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | |
(1)20℃时,30g碳酸钠和30g氯化钠的固体混合物加入到100g水中,充分搅拌后_____(填“是”或“否”)有固体剩余。
(2)生活在盐湖附近的人们“夏天晒盐(氯化钠)”、“冬天捞碱(碳酸钠)”,其冬天捞碱依据的原理是___________(填“蒸发结晶”或“降温结晶”)。
(3)将300g碳酸钠溶液和150g石灰水溶液混合后,恰好完全反应,过滤,得到白色沉淀50g,则所得的滤液中溶质的质量分数多少_____________?。