题目内容
【题目】酸、碱、盐是重要的化合物,研究它们的性质有重要意义。
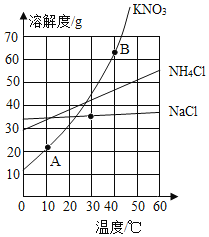
(1)NaCl、KNO3、NH4Cl三种固体在水中的溶解度曲线如图所示,请仔细观察曲线,回答下列问题:①三种固体物质的溶解度受温度影响最小的是_____。
②30℃时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是_____。
③50℃时将20gNH4Cl固体加入到50g水中,充分溶解后,所得溶液是_____溶液。(填“饱和”或“不饱和”)
④图中A、B点的坐标为:A(10,21)、B(40,64).若将100g40℃的硝酸钾饱和水溶液降温到10℃,析出KNO3固体的质量为_____g(保留一位小数)。(保留一位小数)
(2)有一包白色固体,可能含有氧化钙、硝酸钾、碳酸钠、碳酸钙中的一种或几种。为探究其成分进行如下实验

①固体中一定含有____________________。
②固体中一定没有____________________。
③写出产生白色沉淀的化学方程式_______________;反应类型为_____。
【答案】 氯化钠 硝酸钾、氯化铵、氯化钠 不饱和 26.2 g Na2CO3 CaCO3 、CaO Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 复分解反应
【解析】(1)①有溶解度曲线可知,三种固体物质的溶解度受温度影响最小的是氯化钠;②30℃时,三种固体的溶解度大小为三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是KNO3![]() NH4Cl
NH4Cl![]() NaCl,故30℃时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是KNO3
NaCl,故30℃时三种固体物质饱和水溶液中溶质的质量分数由大到小的顺序是KNO3![]() NH4Cl
NH4Cl![]() NaCl;③50℃时氯化铵的溶解度大于50g,故50℃时将20gNH4Cl固体加入到50g水中,充分溶解后,所得溶液是不饱和溶液;④40℃的硝酸钾的溶解度是64g,设100g该溶液中硝酸钾的质量为x,
NaCl;③50℃时氯化铵的溶解度大于50g,故50℃时将20gNH4Cl固体加入到50g水中,充分溶解后,所得溶液是不饱和溶液;④40℃的硝酸钾的溶解度是64g,设100g该溶液中硝酸钾的质量为x,![]() =
=![]() ,x=39g,水的质量为61g,10℃时硝酸钾的溶解度为21g,故设61g水中最多能溶解硝酸钾的质量为y,
,x=39g,水的质量为61g,10℃时硝酸钾的溶解度为21g,故设61g水中最多能溶解硝酸钾的质量为y,![]() =
=![]() ,y=12.8,故降温到10℃,析出KNO3固体的质量为39g-12.8g=26.2g;
,y=12.8,故降温到10℃,析出KNO3固体的质量为39g-12.8g=26.2g;
(2)①几种物质中能使澄清石灰水变浑浊的物质是碳酸钠,故固体中一定含有Na2CO3
②固体加入足量的水后没有固体出现,故溶液中一定没有碳酸钙,固体中一定有碳酸钠,故一定没有氧化钙,故固体中一定没有碳酸钙和氧化钙;
③氢氧化钙和碳酸钠反应生成碳酸钙沉淀和水,反应方程式为Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;反应类型为复分解反应;

【题目】氯化钠、碳酸钠不同温度下的溶解度如下表所示,请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 |
氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | |
(1)20℃时,30g碳酸钠和30g氯化钠的固体混合物加入到100g水中,充分搅拌后_____(填“是”或“否”)有固体剩余。
(2)生活在盐湖附近的人们“夏天晒盐(氯化钠)”、“冬天捞碱(碳酸钠)”,其冬天捞碱依据的原理是___________(填“蒸发结晶”或“降温结晶”)。
(3)将300g碳酸钠溶液和150g石灰水溶液混合后,恰好完全反应,过滤,得到白色沉淀50g,则所得的滤液中溶质的质量分数多少_____________?。