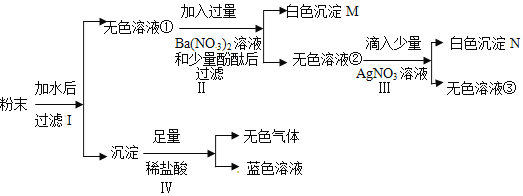
题目内容
【题目】家庭养观赏鱼时会在鱼缸里放点“鱼浮灵”,可使水中的含氧量迅速增加。“鱼浮灵”
主要成分是过碳酸钠(xNa2CO3 yH2O2),俗称固体双氧水。某化学兴趣小组对其进行探究。
Ⅰ. “鱼浮灵”的性质研究
实验1:取少量“鱼浮灵”于试管中加水,有持续细小气泡缓慢放出;继续向试管中加有少量MnO2粉末,产生大量气泡。将带火星的木条伸入试管,木条_____________,说明有O2生成,该反应的化学方程式为____________________________。
实验2:取实验1中上层清液,测得溶液pH > 7,说明溶液呈____性(填“酸”、“碱”或“中”);向溶液中滴加足量稀盐酸,产生大量气泡,将产生的气体通入澄清石灰水中,出现浑浊现象,说明有_________生成。
结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
Ⅱ. “鱼浮灵”的制备研究
“鱼浮灵”的工业制备流程如下:
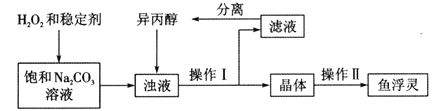
【查阅资料】 异丙醇为有机溶剂,水与异丙醇可以互溶,过碳酸钠在异丙醇中溶解度较小。
稳定剂中MgCl2和 Na2SiO3发生复分解反应,生成一种难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为_________。浊液中加入异丙醇的作用是________。
Ⅲ. “鱼浮灵”的组成研究
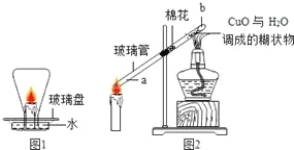
利用下图装置进行产品过碳酸钠(xNa2CO3 yH2O2)组成的测定(杂质对测定无影响)。

⑴实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应,继续缓慢通N2。继续缓慢通N2的目的是________。
⑵B装置中浓硫酸的作用是_________________________________;
E装置的作用是________________________________________。
⑶若先滴入稀硫酸,后加热铜网,会导致x : y的值__________ (填“偏大”或“偏小”)。
⑷实验测得C装置中铜网增重1.2g,D装置增重2.2g,则x : y =_______。 (写出计算过程)
【答案】 复燃 2H2O2 MnO2 2H2O+O2↑ 碱 CO2 MgCl2 + Na2SiO3 = MgSiO3↓ + 2NaCl 减少过碳酸钠的溶解,提高鱼浮灵的产率 让A中产生的气体全部被C、D装置所吸收 干燥生成的气体(或干燥O2和CO2)等合理即可 防止空气中的H2O和CO2进入D装置 偏大 2:3
【解析】(1)过氧化氢与遇到二氧化锰由大量的氧气生成,故带火星的木条复燃;该反应是过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,反应方程式为2H2O2 MnO2 2H2O+O2↑;溶液pH > 7,说明溶液呈碱性;能使澄清石灰水变浑浊的气体是二氧化碳气体;
Ⅱ。氯化镁与硅酸钠反应生成硅酸镁沉淀和氯化钠,反应方程式为MgCl2 + Na2SiO3 = MgSiO3↓ + 2NaCl;浊液中加入异丙醇可以减少过碳酸钠的溶解,提高鱼浮灵的产率;
Ⅲ. ⑴ 继续缓慢通N2的目的是让A中产生的气体全部被C、D装置所吸收;
(2)浓硫酸具有吸水性,故B装置中浓硫酸的作用是吸水水分,防止水分进入D装置;E装置的作用是防止空气中的水分进入D装置;
(3)若先滴入稀硫酸,后加热铜网部分氧气不能被吸收,故y的值偏小,故x:y偏大;由题可知,生成氧气的质量为1.2g,生成二氧化碳的质量为2.2g,设碳酸钠的质量为m
Na2CO3+H2SO4=Na2SO4+CO2![]() +H2O
+H2O
106 44
m 2.2g
![]() =
=![]() m=5.3g
m=5.3g
设过氧化氢的质量为n
2H2O2 MnO2 2H2O+O2↑
68 32
n 1.2g
![]() =
=![]() n=2.55g
n=2.55g
故![]() =
=![]() , x:y=2:3
, x:y=2:3

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
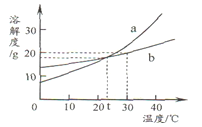
小学同步三练核心密卷系列答案【题目】氯化钠、碳酸钠不同温度下的溶解度如下表所示,请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 碳酸钠 | 7.0 | 12.5 | 21.5 | 39.7 | 49.0 |
氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | |
(1)20℃时,30g碳酸钠和30g氯化钠的固体混合物加入到100g水中,充分搅拌后_____(填“是”或“否”)有固体剩余。
(2)生活在盐湖附近的人们“夏天晒盐(氯化钠)”、“冬天捞碱(碳酸钠)”,其冬天捞碱依据的原理是___________(填“蒸发结晶”或“降温结晶”)。
(3)将300g碳酸钠溶液和150g石灰水溶液混合后,恰好完全反应,过滤,得到白色沉淀50g,则所得的滤液中溶质的质量分数多少_____________?。