题目内容
【题目】空气中氧气含量测定的再认识
Ⅰ. 用红磷测定空气中氧气的含量。
(1)请写出红磷在空气中燃烧的化学表达式________。
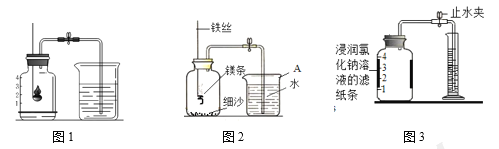
(2)如图1所示进行实验, 测得空气中氧气的含量小于1∕5,可能的原因是 ____(填序号)。
A.燃烧匙伸入集气瓶太慢 B.红磷量不足
C. 实验中发现导管口有气泡冒出 D.装置漏气
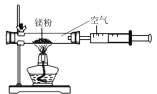
Ⅱ. 用镁条测定空气中氧气的含量。
(3)请写出镁条在氧气中燃烧的化学表达式_____________。
(4)某同学利用图2实验测定空气中氧气含量时发现,产物中还出现少许黄色固体。
已知:镁能与氮气反应生成淡黄色的氮化镁(Mg3N2)固体。 但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是_________。在操作规范的情况下,该同学实验所测得的氧气体积分数______1/5(填“大于”、“小于”或“等于”)。
Ⅲ. 用铁粉测定空气中氧气的含量。
(5)已知铁常温下与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3﹒xH2O)。试写出该反应的化学表达式________。
(6)某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图实验,8分钟后测得数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
250mL | 180.0mL | 129.5mL |
实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再把该滤纸条贴在广口瓶内侧,其目的是________。根据表中数据计算得出空气中氧气的体积分数为________(结果保留到0.1%)。与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点一是没有污染,二是 ____________。
Ⅳ.拓展应用
(7)取2.4g镁条在O2和N2的混合气体中完全燃烧,所得固体质量为ag,,则a的取值范围是________g<a g<4g(结果保留到0. 1g)。
(8)已知:Fe2O3固体在一定的高温下能分解为一种复杂的铁的氧化物和一种气体。 该气体可以用___________来检验。现将64.0gFe2O3固体加热到该温度下,发现固体质量减少了3.2g后质量不再改变。请回答:64.0gFe2O3固体中含有铁元素_______g;该温度下复杂的铁的氧化物的化学式为__________。
【答案】P+O2 ![]() P2O5 BD Mg+O2
P2O5 BD Mg+O2![]() MgO 氧气的化学性质比氮气活泼 大于 Fe+O2 +H2O Fe2O3﹒xH2O 加快反应速率(或增大接触面积、充分反应等) 20.2% 能将空气中的氧气完全耗尽,使实验结果更加准确 3.3 带火星的木条 44.8 Fe4O5
MgO 氧气的化学性质比氮气活泼 大于 Fe+O2 +H2O Fe2O3﹒xH2O 加快反应速率(或增大接触面积、充分反应等) 20.2% 能将空气中的氧气完全耗尽,使实验结果更加准确 3.3 带火星的木条 44.8 Fe4O5
【解析】
(1)红磷在空气中燃烧生成五氧化二磷,化学表达式为:P+O2 ![]() P2O5;
P2O5;
(2)若进入集气瓶中水的体积不到总容积的1/5,则瓶内气压减小量也不到原压强的1/5,即氧气没有耗尽或实验完毕后有气体进入装置。A、燃烧匙伸入集气瓶太慢,有部分空气逸出,测量结果偏大;故A错误;B、红磷量不足,没有将氧气完全消耗,测量结果偏小,故B正确;C、实验中发现导管口有气泡冒出,有部分空气逸出,测量结果偏大,故C错误; D、装置漏气,实验完毕后有气体进入装置,测量结果偏小,故D正确,故选BD。
(3)镁条在氧气中燃烧生成氧化镁,化学表达式为:Mg+O2![]() MgO;
MgO;
(4)空气中N2的含量远大于O2的含量,但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是氧气的化学性质比氮气活泼,镁更容易与氧气反应;由于有氮气参加了反应,在操作规范的情况下,该同学实验所测得的氧气体积分数大于1/5;
(5)根据铁常温下与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3﹒xH2O)。该反应的化学表达式为:Fe+O2 +H2O Fe2O3﹒xH2O;
(6)实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再把该滤纸条贴在广口瓶内侧,其目的是加快反应速率(或增大接触面积、充分反应等);空气中氧气的体积=180.0mL-129.5mL=50.5mL,空气中氧气体积分数=![]() ;与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点一是没有污染,二是能将空气中的氧气完全耗尽,使实验结果更加准确;
;与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点一是没有污染,二是能将空气中的氧气完全耗尽,使实验结果更加准确;
(7)若镁全部与氮气反应生成氮化镁的质量=![]() ,镁全部与氧气反应生成氧化镁的质量为4g,取2.4g镁条在O2和N2的混合气体中完全燃烧,所得固体质量为ag,则a的取值范围是3.3g<a g<4g;
,镁全部与氧气反应生成氧化镁的质量为4g,取2.4g镁条在O2和N2的混合气体中完全燃烧,所得固体质量为ag,则a的取值范围是3.3g<a g<4g;
(8)根据“Fe2O3固体在一定的高温下能分解为一种复杂的铁的氧化物和一种气体”和质量守恒定律可知,反应生成的气体是氧气,氧气具有助燃性,能使带火星的木条复燃,检验氧气可以用带火星的木条来检验;64.0gFe2O3中氧元素的质量=![]() ,铁元素的质量=64g-19.2g=44.8g;将64.0gFe2O3固体加热到该温度下,发现固体质量减少了3.2g后质量不再改变。减小的质量为产生氧气的质量,生成的复杂铁的氧化物中含氧元素的质量为:19.2g-3.2g=16g;复杂的铁的氧化物中铁原子与氧原子的个数比=
,铁元素的质量=64g-19.2g=44.8g;将64.0gFe2O3固体加热到该温度下,发现固体质量减少了3.2g后质量不再改变。减小的质量为产生氧气的质量,生成的复杂铁的氧化物中含氧元素的质量为:19.2g-3.2g=16g;复杂的铁的氧化物中铁原子与氧原子的个数比=![]() ,则复杂的铁的氧化物化学式为:Fe4O5。
,则复杂的铁的氧化物化学式为:Fe4O5。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案