题目内容
【题目】空气是宝贵的自然资源,下图是以空气等为原料合成尿素[CO(NH2)2]的流程。下列关于该实验的说法正确的是
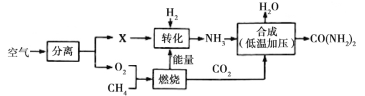
A. X是空气中含量最多的气体
B. 将空气降温加压后分离出X气体时,应控制温度大于O2的沸点,小于X的沸点
C. 为加快“转化”速率,可在转化过程中使用催化剂
D. “合成”反应的化学表达式为:CO2+ H2O![]() CO(NH2)2
CO(NH2)2
【答案】AC
【解析】
A、空气中氧气体积分数为21%,氮气的体积分数为78%,稀有气体分数为0.94%,二氧化碳体积分数为0.03%,其他气体和杂质的体积分数为0.03%。根据流程图可知,空气经分离得到了O2和X,所以X为空气中含量最多的气体,故A正确;B、分离空气的主要方法是将液态空气气化,N2的沸点低于O2,先蒸发出氮气,应控制温度小于O2的沸点,大于N2的沸点,故B错误;C、催化剂在化学反应中,能改变化学反应的速率,而本身的质量和化学性质不变。为加快“转化”速率,可在转化过程中使用催化剂,故C正确;D、根据流程图可知,“合成”反应中,反应物是CO2和 NH3,生成物是CO(NH2)2和H2O,化学表达式为:CO2+ NH3![]() CO(NH2)2+ H2O,故D错误。故选AC。
CO(NH2)2+ H2O,故D错误。故选AC。

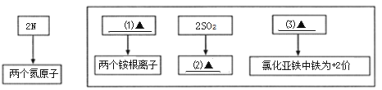
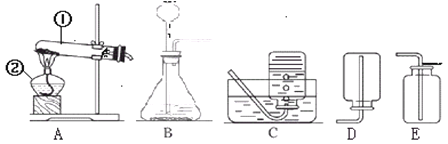
【题目】化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:小婧同学在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
(提出问题)为什么会生成淡黄色固体?
(查阅资料)小婧查阅资料,记录了下列几种物质的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
其他同学认为不必查阅氯化镁的颜色,理由是________;
(提出猜想)分析资料,小婧认为淡黄色固体可能是由镁与空气中的________(填化学式)反应生成的;
(实验探究)小婧设计实验证实了自己的猜想,她的实验操作可能是_________;
(实验结论)根据小婧实验结果,写出镁条在空气中燃烧时两个反应符号表达式:__________、______________。
(反思与评价)通过上述实验,你对燃烧有什么新的认识?__________。
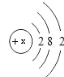
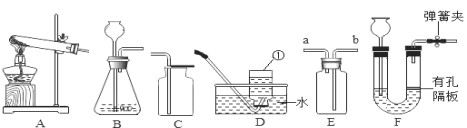
【题目】空气中氧气含量测定的再认识
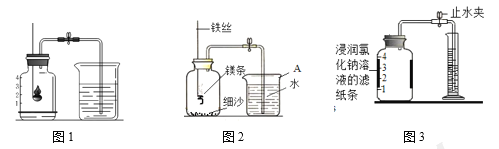
Ⅰ. 用红磷测定空气中氧气的含量。
(1)请写出红磷在空气中燃烧的化学表达式________。
(2)如图1所示进行实验, 测得空气中氧气的含量小于1∕5,可能的原因是 ____(填序号)。
A.燃烧匙伸入集气瓶太慢 B.红磷量不足
C. 实验中发现导管口有气泡冒出 D.装置漏气
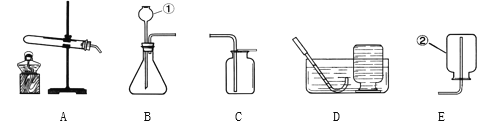
Ⅱ. 用镁条测定空气中氧气的含量。
(3)请写出镁条在氧气中燃烧的化学表达式_____________。
(4)某同学利用图2实验测定空气中氧气含量时发现,产物中还出现少许黄色固体。
已知:镁能与氮气反应生成淡黄色的氮化镁(Mg3N2)固体。 但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是_________。在操作规范的情况下,该同学实验所测得的氧气体积分数______1/5(填“大于”、“小于”或“等于”)。
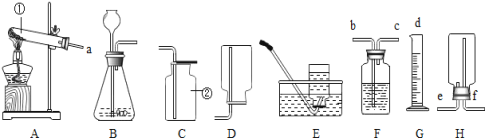
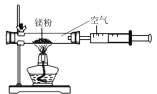
Ⅲ. 用铁粉测定空气中氧气的含量。
(5)已知铁常温下与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3﹒xH2O)。试写出该反应的化学表达式________。
(6)某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图实验,8分钟后测得数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
250mL | 180.0mL | 129.5mL |
实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再把该滤纸条贴在广口瓶内侧,其目的是________。根据表中数据计算得出空气中氧气的体积分数为________(结果保留到0.1%)。与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点一是没有污染,二是 ____________。
Ⅳ.拓展应用
(7)取2.4g镁条在O2和N2的混合气体中完全燃烧,所得固体质量为ag,,则a的取值范围是________g<a g<4g(结果保留到0. 1g)。
(8)已知:Fe2O3固体在一定的高温下能分解为一种复杂的铁的氧化物和一种气体。 该气体可以用___________来检验。现将64.0gFe2O3固体加热到该温度下,发现固体质量减少了3.2g后质量不再改变。请回答:64.0gFe2O3固体中含有铁元素_______g;该温度下复杂的铁的氧化物的化学式为__________。