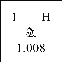
题目内容
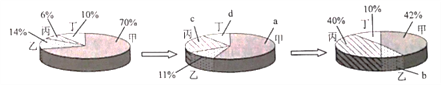
【题目】CO2是重要的资源,以其为原料可获得下列四种物质.下列说法错误的是
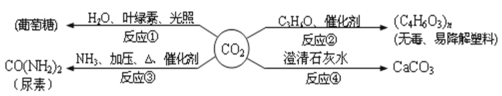
A. 反应①是太阳能转化为化学能
B. 反应①是自然界中最重要的化学反应,属于缓慢氧化反应
C. 反应②的实现有利于缓解“白色污染”
D. 反应④可用于检验CO2气体,是化合反应
【答案】BD
【解析】
A、根据图示可知,反应①是光合作用,光合作用是太阳能转化为化学能,故A正确;B、根据图示可知,反应①是光合作用,是二氧化碳与水反应生成葡萄糖和氧气,不属于缓慢氧化,故B错误;C、根据图示可知,反应②中的反应得到了无毒、易降解的塑料,有利于缓解“白色污染”,故C正确;D、反应④是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,生成物是两种,不符合“多变一”的形式,不符合化合反应的特征,不属于化合反应,故D错误。故选BD。

 阅读快车系列答案
阅读快车系列答案【题目】化学是造福人类的科学.
(一)生活中的化学
(1)市场上食用钙片、补铁酱油中的“钙”、“铁”指的是______.
A.分子 B.原子 C.单质 D.元素
(2)构成加碘盐中主要成分氯化钠的阴离子是______(写离子符号)
(3)净水时,为了加快水中悬浮颗粒沉降,可以向水中加入______(填物质名称).
(4)蒸馏水不宜养鱼,是因为蒸馏水中几乎不含_________(填字母序号).
A.氧元素 B. 氧原子 C. 氧分子 D. 氧离子
(二)农业上化肥的使用探究
(5)下图是某化肥碳酸氢铵包装袋上的商标,商标上可知碳酸氢铵具有的性质是__(填字母).
A.易溶于水 B.有挥发性 C.受热易分解

(6)这种化肥含氮量是否达到16%,化肥中碳酸氢铵的含量是多少?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室.
(查找资料)①碱石灰能够吸收水和CO2,但是不吸收NH3.
②浓硫酸能吸收NH3但是不吸收CO2.
③氨气溶于水形成氨水
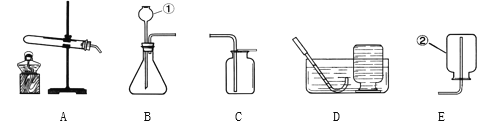
(性质探究)该同学设计了如下的实验装置:
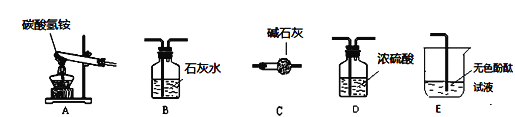
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是________.
②取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是_____.
③连接A、B装置,继续加热,观察到试管口的现象是____,B中的现象是____.
④碳酸氢铵在受热时发生反应的化学式表达式是____________.
(含量分析)将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失.她称量装置D的质量如表:
实验前D装置的质量 | 149g |
实验后D装置的质量 | 152.4g |
⑤由此分析得知:反应中产生氨气的质量为_______g.
⑥通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素质量分数为_______.
⑦请计算此化肥中碳酸氢铵的纯度________.
⑧______千克的尿素[CO(NH2)2]和这袋化肥的含氮元素质量相等.
【题目】化学实验中常常会出现意外情况,这是提升我们学科素养的良好机会,要根据具体情况区别对待,善于发现和解决问题.例如:小婧同学在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
(提出问题)为什么会生成淡黄色固体?
(查阅资料)小婧查阅资料,记录了下列几种物质的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
其他同学认为不必查阅氯化镁的颜色,理由是________;
(提出猜想)分析资料,小婧认为淡黄色固体可能是由镁与空气中的________(填化学式)反应生成的;
(实验探究)小婧设计实验证实了自己的猜想,她的实验操作可能是_________;
(实验结论)根据小婧实验结果,写出镁条在空气中燃烧时两个反应符号表达式:__________、______________。
(反思与评价)通过上述实验,你对燃烧有什么新的认识?__________。
【题目】空气中氧气含量测定的再认识
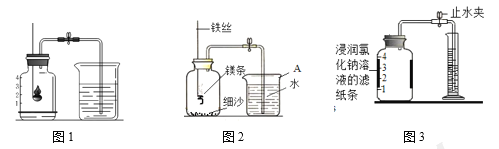
Ⅰ. 用红磷测定空气中氧气的含量。
(1)请写出红磷在空气中燃烧的化学表达式________。
(2)如图1所示进行实验, 测得空气中氧气的含量小于1∕5,可能的原因是 ____(填序号)。
A.燃烧匙伸入集气瓶太慢 B.红磷量不足
C. 实验中发现导管口有气泡冒出 D.装置漏气
Ⅱ. 用镁条测定空气中氧气的含量。
(3)请写出镁条在氧气中燃烧的化学表达式_____________。
(4)某同学利用图2实验测定空气中氧气含量时发现,产物中还出现少许黄色固体。
已知:镁能与氮气反应生成淡黄色的氮化镁(Mg3N2)固体。 但在空气中燃烧镁条时很难观察到生成物中有淡黄色固体,原因是_________。在操作规范的情况下,该同学实验所测得的氧气体积分数______1/5(填“大于”、“小于”或“等于”)。
Ⅲ. 用铁粉测定空气中氧气的含量。
(5)已知铁常温下与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3﹒xH2O)。试写出该反应的化学表达式________。
(6)某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图实验,8分钟后测得数据如表:
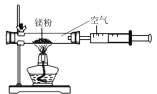
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
250mL | 180.0mL | 129.5mL |
实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再把该滤纸条贴在广口瓶内侧,其目的是________。根据表中数据计算得出空气中氧气的体积分数为________(结果保留到0.1%)。与用红磷燃烧的方法相比,用该方法测定空气中氧气的含量的主要优点一是没有污染,二是 ____________。
Ⅳ.拓展应用
(7)取2.4g镁条在O2和N2的混合气体中完全燃烧,所得固体质量为ag,,则a的取值范围是________g<a g<4g(结果保留到0. 1g)。
(8)已知:Fe2O3固体在一定的高温下能分解为一种复杂的铁的氧化物和一种气体。 该气体可以用___________来检验。现将64.0gFe2O3固体加热到该温度下,发现固体质量减少了3.2g后质量不再改变。请回答:64.0gFe2O3固体中含有铁元素_______g;该温度下复杂的铁的氧化物的化学式为__________。